Här beskrivs en icke-rökande patient med recidiverande respiratoriska papillom, genotypade som humant papillomvirus typ 11 (HPV 11).
Patienten har behandlats med koldioxidlaser 133 gånger; de senaste 28 gångerna ventilerades han med högfrekvent jetventilationsteknik.
Efter HPV-vaccination med Gardasil och operation i september 2013 bedömdes patienten vara i remission, men i mars 2015 ställdes diagnosen HPV 11-positiv lungcancer.
Patienter med recidiverande respiratoriska papillom bör ventileras med högfrekvent jetventilationsteknik för att ge bästa förutsättningar för kirurgisk radikalitet och bevarad funktionalitet.
Operationspersonal bör skyddas mot droppburen respiratorisk HPV-smitta genom munskydd, optimerat lokalt utsug och hög luftväxling på operationssal.
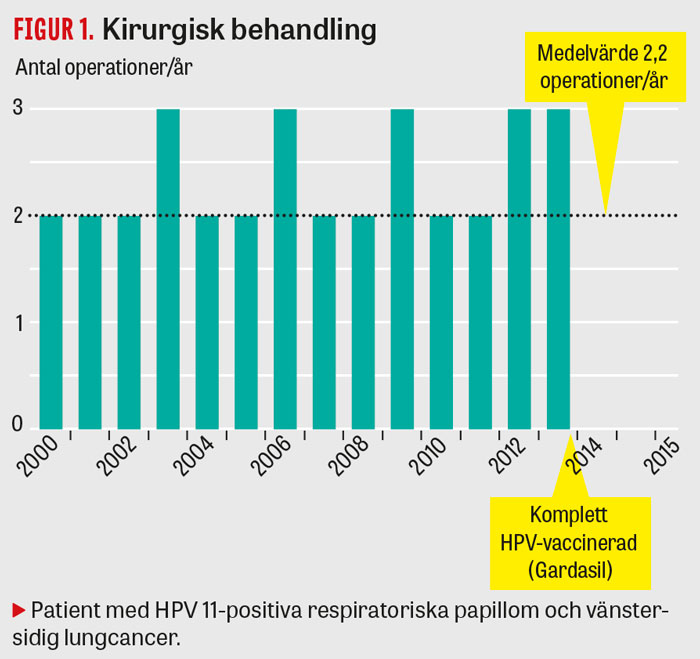
Figur 1.
Vi vill med denna fallbeskrivning diskutera hur det kirurgiska omhändertagandet av patienter med recidiverande respiratoriska papillom kan optimeras. Öppen ventilationsteknik och koldioxidlaser skapar förutsättning för god tillgänglighet och radikal kirurgi i luftstrupen men ger samtidigt spridning i såväl luftväg som omkringliggande luftrum. Vår avsikt är att belysa behovet av att skydda personal på operationssal från viral droppsmitta genom anpassade munskydd, lokalt utsug och hög luftväxling i operationssal.
Fallbeskrivning
Fallet rör en i övrigt tidigare frisk man, icke-rökare med arbete som chaufför. Vid 6 månaders ålder, i slutet av 1950-talet, diagnostiserades han med recidiverande respiratoriska papillom. Först då han var i sen medelålder subtypades dessa som humant papillomvirus (HPV) genotyp 11 genom modifierad PCR och Luminex-analys med prober för bl a HPV 16, 18, 31, 33 samt 6 och 11.
Det kliniska förloppet var lågaktivt med ett 10-tal kirurgiska interventioner (kalla instrument) upp till vuxen ålder. Patienten har sövts 133 gånger, varav de senaste 28 gångerna med högfrekvent jetventilationsteknik. Papillomvegetationer i larynx fanns transglottalt med övervikt på glottis bilateralt, inkluderat främre och bakre kommissuren. Papillomen fanns också i subglottiska rummet men respekterade krikoidplattans övre kant. Supraglottiska papillom växte upp mot epiglottisbasen bilateralt.
Patienten har behövt behandling med intervall om 4 till 6 månader (Figur 1). På grund av obesitas och trång intubationsväg har han varit tekniskt svår att ventilera. Han erbjöds därför, utan evidensbaserat stöd, försök med terapeutisk HPV-vaccination (Gardasil). Vaccinationen omfattade tre doser och avslutades i februari 2013 (Figur 1). Den senaste kirurgiska behandlingen gavs i september 2013, och han betraktades då vara i tillfällig remission.
I december 2014 diagnostiserades han med akut njursvikt, sekundär till nyupptäckt insulinkrävande diabetes. Under vårdtiden utfördes lungröntgen, vilken visade en förtätning på vänster lunga. Förtätningen kvarstod vid kontrollröntgen efter 4 veckor, och en datortomografiledd finnålsbiopsi visade prolifererande skivepitel. Patienten hade vid tidpunkten inga symtom från lungorna, och undersökning med spirometri och arbets-EKG visade normala fynd.
I mars 2015 utfördes en vänstersidig lobektomi, där fryssnitt verifierade högt differentierad skivepitelcancer. Vid efterföljande genotypning av det paraffininbäddade preparatet konstaterades tumören vara positiv för HPV 11. Patienten har sedan dess avslutat cytostatikabehandling och är i nuläget tumörfri.
Humant papillomvirus och tumörutveckling
HPV har ett cirkulärt DNA. Höljeproteinet L1 kan självt bilda viruslika partiklar, och dessa används som vaccin mot HPV 16, 18, 6 och 11 (Gardasil). HPV 6 och 11 betraktas som lågriskvirus, medan HPV 16, 18, 31 och 33 anses förknippade med högre risk att utveckla cancer i vävnaden [1]. Rökning utgör den i särklass största riskfaktorn för lungcancer [2]. Sedan slutet av 1970-talet har HPV associerats med insjuknande i lungcancer [3]. HPV-relaterad lungcancer är vanligare i Asien än i Europa och USA, i vissa områden anges 22 procent av tumörerna vara positiva för HPV [4].
HPV 11 har beskrivits i lungcancer hos patienter med recidiverande respiratoriska papillom i ett flertal rapporter [5-8]. Recidiverande respiratoriska papillom som genotypas positiva för HPV 11 representerar en mer aggressiv sjukdom [9] eftersom de visar ett mera utbrett växtsätt, vilket leder till att patienter behöver opereras oftare.
Recidiverande respiratoriska papillom
Recidiverande respiratoriska papillom orsakas vanligen av HPV typ 6 och 11. Incidensen är låg: 0,17/100 000 hos barn upp till 18 år och 0,54/100 000 hos vuxna [10]. Tidig debut anses vara förknippad med ett mer aggressivt sjukdomsförlopp [9]. Recidiverande respiratoriska papillom har låg mortalitet men hög morbiditet genom påverkan på röst, andning och social funktionsnivå [11].
Patienter måste genomgå livslång återkommande kirurgisk behandling i narkos, där intervallen vanligen varierar mellan 1 och 4 interventioner per år. De kirurgiska metoderna är symtomlindrande; kurativ behandling saknas.
Det finns i dag inga nationella eller internationella accepterade riktlinjer för val av kirurgisk metod eller ventilationsteknik vid recidiverande respiratoriska papillom. Vanligen används koldioxidlaser och kalla instrument samt koblationstekniker för att kirurgiskt reducera papillomvegetationer i struphuvudet.
Tilläggsbehandling till kirurgi används då kirurgi sviktar, t ex indol-3-karbinol, cidofovir eller bevacizumab [12]. Gardasil är ett vaccin mot HPV 6, 11, 16 och 18, vilket i Sverige erbjuds profylaktiskt till flickor vid 9 till 13 års ålder. Små studier har indikerat att vaccinet kan fungera även terapeutiskt som tillägg till kirurgi vid recidiverande respiratoriska papillom [13].
Högfrekvent jetventilation
För att optimera möjligheten till radikalitet vid kirurgisk behandling av recidiverande respiratoriska papillom måste hela luftvägen vara tillgänglig och inte blockeras av en intubationstub. Högfrekvent jetventilation kan tillämpas på olika sätt. Genom en ventil tillförs patienten små gasportioner via en smal kateter som förs ned nedanför stämbanden. Gasen lämnar katetern som pulsade högfrekventa jetstrålar. Fördelen är att patienten ventileras nedom sina respiratoriska papillom. Nackdelen är att katetern tar utrymme, vilket begränsar anestesiologens monitoreringsmöjligheter.
För att ytterligare förbättra insyn i luftvägen kan en speciell typ av högfrekvent jetventilationsteknik (superimposed high-frequency jet ventilation technique) användas, där patienten ventileras utan tub eller kateter genom ett specialanpassat jetlaryngoskop. Förutom god tillgänglighet till luftvägen kan patienten ventileras med upp till 100 procent syrgas under behandling med koldioxidlaser. Om brännbart material finns i luftvägen, t ex intubationstub eller kateter, får patienten inte ventileras med mer än 40 procent syrgas. Vidare kan anestesiologen påverka och monitorera koldioxideliminering och diffusionseffekt. Gasportionerna kan ges med en tidalvolym på 1–3 ml/kg och vid mycket varierande andningsfrekvenser i kombination med olika gasströmmar, vilket säkrar ventilation hos patienter med samsjuklighet och funktionellt ökad risk [14].
Partikelspridning under kirurgi
Kirurgisk rök kan vara farlig för operationspersonal genom att såväl toxiska gaser som mikroorganismer kan överföras [15]. Koldioxidlaser skapar större partiklar än vad t ex diatermi gör, och därmed finns förutsättning för högre partikeltäthet med viabelt HPV-DNA vid användning av koldioxidlaser [16]. Det är visat att HPV [17], poliovirus [18] och hiv [19] kan överleva även vid behandling med koldioxidlaser.
Det är känt att kirurger som behandlar med koldioxidlaser löper ökad risk att smittas av HPV, även utan arbete i en luftström riktad från patientens luftväg mot operatören, t ex vid gynekologisk HPV-kirurgi [20].
Diskussion
Recidiverande respiratoriska papillom har stor påverkan på patientens röst och sociala livskvalitet [11], och majoriteten är positiva för HPV 6 och 11 [21]. Vår patient var positiv för genotyp HPV 11 i larynx och i skivepitelcancer i vänster lunga. Det har spekulerats kring ventilationsbetingad implantationsmetastasering av recidiverande respiratoriska papillom till distal luftväg, även om lungcancer kan vara HPV-positiv utan kända recidiverande respiratoriska papillom [22]. HPV 11 antas vara mer aggressiv i luftväg än HPV 6 [9]. Hos patienter med recidiverande respiratoriska papillom i Sverige är andelen HPV 11 avsevärt mindre än HPV 6, ca 15 procent respektive ca 80 procent [23].
Det mer aggressiva förloppet vid HPV 11-positiva recidiverande respiratoriska papillom manar till ett mer organiserat omhändertagande än vid HPV 6-infektion.
Hur uppföljning av dessa patienter ska ske behöver vetenskapligt bekräftas, och med tanke på tillståndets ovanlighet behövs sannolikt randomiserade multicenterstudier. Om behandlingsfrekvens liksom utbredning av recidiverande respiratoriska papillom i luftvägen ökar, betingar det enligt vår uppfattning kontrolldiagnostiska biopsier, förnyad HPV-typning och diagnostisk trakeobronkoskopi samt i vissa fall radiologisk kontroll (datortomografiundersökning av hals/torax). För patienter med aggressivt sjukdomsförlopp vid recidiverande respiratoriska papillom krävs vanligen kirurgi med dels fler operationer per observerad tid, dels längre operationstid. För att uppnå så hög radikalitet vid kirurgi (och därmed röstfunktionalitet) och anestesiologisk säkerhet som möjligt bör patienterna ventileras under kirurgi med en speciell typ av högfrekvent jetventilationsteknik [14].
Risken för implantationsmetastaser av HPV 11-positiva recidiverande respiratoriska papillom ner i lunga bör beaktas. Vi vet i dag inte om vår patient fick sin lungcancer av sina behandlade respiratoriska papillom. Vid koldioxidlaserkirurgi frigörs en bit av respiratorisk slemhinna med viabelt HPV, varmed förutsättning för droppsmitta skapas [15, 17]. Det kan inte uteslutas att droppsmitta med högfrekvent jetventilationsteknik kan förekomma såväl ner i patientens luftvägar som upp i operationsrummets luftrum.
Slutsatser
Baserat på kunskap om vikten av radikalitet vid kirurgi och säker ventilation under ingreppen samt oklarheter rörande risk för spridning av HPV i luftvägen förespråkar vi att patienter med recidiverande respiratoriska papillom oförändrat ventileras med högfrekvent jetventilationsteknik.
Risk för smitta av operationspersonal finns, och personal bör skyddas mot droppsmitta genom anpassade munskydd, optimerat lokalt utsug och hög luftväxling i operationssal.
Vi saknar i dag vetenskapligt stöd för att använda vaccination mot HPV i terapeutiskt syfte, eller som profylax i en population, men små studier har visat att detta i en framtid kan bli möjligt [13].
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.






















