Celiaki ansågs länge som en ovanlig barnsjukdom, men är en vanlig sjukdom som drabbar alla åldrar.
Genomförda screeningar av normalbefolkningen visar att merparten inte fått diagnos eller behandling.
Den kliniska bilden varierar: alltifrån diffusa besvär eller inga symtom alls till allvarliga gastrointestinala symtom med grav avmagring och tillväxtrubbning till följd av malabsorption.
Klinisk misstanke om eller hereditet för celiaki bör föranleda analys av specifika serologiska markörer. Gastroskopi med tunntarmsbiopsi bör övervägas för att bekräfta eller utesluta diagnosen.
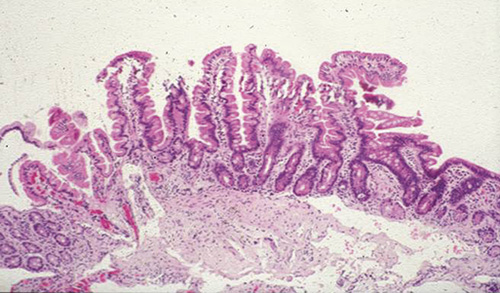
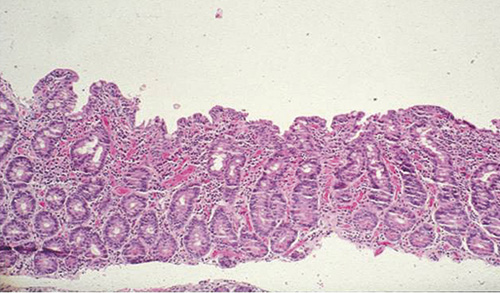
Celiaki orsakas av proteinet gluten i vete, råg och korn som initierar en inflammation, vilken slutligen leder till villusatrofi av tunntarmens slemhinna (Figur 1).
År 1888 rapporterades de första kliniska fallen av barn med celiaki. Först ett halvt sekel senare visade barnläkaren Dicke på kopplingen mellan celiaki och intag av gluten från vetemjöl [1]. När tunntarmskapslarna utvecklades på 1950-talet kunde biopsier från slemhinnan undersökas och typiska histologiska förändringar påvisades. Dessa förändringar normaliserades vid behandling med glutenfri kost [2] (Figur 1).
Under 1970-talet, då tunntarmskapslarna infördes som klinisk rutin, fastställdes diagnostiska kriterier för celiaki. Dessa innebar att diagnosen ställdes med tre konsekutiva tunntarmsbiopsier: en vid diagnos, en efter period med glutenfri kost och en efter genomförd provokation med gluten [3]. När serologiska markörer introducerades i kliniken reviderades diagnoskriterierna 1991 till att gälla en enda biopsi för att fastställa tunntarmsskada vid diagnos och ytterligare biopsier endast i vissa fall [4].
Under 1980-talet noterade man en dramatisk ökning av svår celiaki hos de yngsta barnen i Sverige. Samtidigt diagnostiserades allt fler fall hos äldre barn och vuxna. Från att ha ansetts vara en sällsynt sjukdom blev celiaki under denna tid en av de vanligaste kroniska sjukdomarna (Figur 2) [5, 6].
Med syfte att undersöka denna epidemi bildades en särskild arbetsgrupp bestående av barnläkare med representation från Sveriges alla sjukvårdsregioner. Arbetsgruppen för celiaki verkar inom Svenska barnläkarföreningens sektion för gastroenterologi, hepatologi och nutrition [7]. Gruppen har bl a initierat ett riksomfattande celiakiregister, som i dag leds och utgår från institutionen för folkhälsa och klinisk medicin vid Umeå universitet. Syftet är att kartlägga och följa utvecklingen över tid samt möjliggöra forskning. Arbetsgruppen ansvarar även för ett nationellt vårdprogram för celiaki hos barn.
Ändrad spädbarnskost gjorde celiaki allt vanligare
Den epidemi av celiaki som startade i mitten av 1980-talet illustrerade att det vid sidan av arvets inflytande måste finnas ytterligare miljö- och/eller levnadsvanor som spelar roll för insjuknandet. Det visade sig att spädbarnskosten hade förändrats över tid och att flera av varandra oberoende förändringar hade samverkat på ett olyckligt sätt. Rekommenderad ålder för introduktion av gluten hade ändrats från 4 månader till 6 månader, vilket innebar att fler barn började med gluten efter det att amningen hade avslutats. Barnmatens alltför höga proteinhalt åtgärdades genom att mängden mjölk minskades; i stället ökades mängden mjöl. Kombinerat innebar detta att många spädbarn blev tämligen abrupt introducerade för gluten, ofta utan pågående amning, vilket har visats öka risken för celiaki [8, 9].
I mitten av 1990-talet rekommenderades i stället gradvis introduktion av gluten, om möjligt under pågående amning, och liksom andra smakportioner kan gluten ges från 4 månaders ålder. Vid samma tid minskades mängden mjöl i industritillverkad barnmat. Detta ledde till att epidemin tämligen prompt klingade av (Figur 2) [5, 6]. I en uppföljande studie visades att denna minskade risk för celiaki kvarstår åtminstone upp till 12 års ålder [9].
I Sverige påvisades på 1990-talet en prevalens på 0,5 procent bland vuxna, vilket kan jämföras med dagens förekomst på 3 procent bland ungdomar födda under den svenska celiakiepidemin (1984–1996) [10], ungdomar som i dag är mellan 17 och 29 år. Det är rimligt att uppskatta antalet personer med celiaki i Sverige i dag till ungefär 150 000 (alla åldrar), varav merparten ännu inte fått diagnos och behandling. Personer med celiaki har rapporterat att de i medeltal väntat 10 år från första symtom till diagnos, och från första läkarbesök för detta symtom till diagnos har det i medeltal dröjt 5,8 år [11]. I flertalet befolkningar tycks celiaki vara ungefär dubbelt så vanligt bland flickor/kvinnor som bland pojkar/män.
Under de senaste årtiondena rapporteras en ökande trend av celiaki, upptäckt såväl kliniskt som genom screening, även från flera andra länder (t ex Finland och USA). Det spekuleras i att orsaken sannolikt finns i något av den »moderna livsstilen«. Mycket av snabbmaten innehåller vetemjöl som förbehandlats, vilket teoretiskt skulle kunna innebära att en viss mängd mjöl blivit mer potent att utlösa celiaki. Omfattande befolkningsstudier behövs för att studera vilka miljöfaktorer som kan vara orsaken till den generella ökningen av celiaki i västvärlden.
En sjukdom med många ansikten
Celiaki kan ge svåra symtom, men vanligare nuförtiden är diskreta och varierande symtom som inte primärt leder tanken till celiaki, varken för den som drabbas eller för hälso- och sjukvårdspersonalen (Fakta 1). Symtom på klassisk celiaki drabbar främst barn i 1–2-årsåldern med viktförlust, putande buk och diarré (eller obstipation). Men även i denna ålder kan symtomen vara väldigt diskreta, t ex bara trötthet och gnällighet.
Celiaki kan debutera i alla åldrar (från spädbarnsålder till ålderdom) och ge diffusa kliniska tecken eller lindriga symtom som inte direkt aktualiserar behovet av en celiakiutredning. Hos äldre barn och ungdomar är symtomen/tecknen ofta inte begränsade till mag–tarmkanalen, utan kan ge extraintestinala manifestationer. Malabsorption kan ge upphov till försenad pubertet, dålig längdtillväxt, amenorré, järnbristanemi, psykiska besvär och kronisk trötthet. Med ökad medvetenhet om sjukdomens olika manifestationer och förbättrade diagnostiska metoder identifieras i dag fler patienter än tidigare med diffusa symtom, s k icke-klassisk celiaki [12] (Fakta 2).
Trots ökad uppmärksamhet och förbättrade serologiska markörer finns ett stort mörkertal. En nyligen genomförd svensk screeningstudie av 12-åringar har påvisat en prevalens på 2–3 procent, varav två tredjedelar hade tidigare oupptäckt celiaki [9]. Liknande siffror finns även från Finland, Italien och USA, men på en lägre nivå. Även om de som upptäcks genom screening ofta har subkliniska eller asymtomatiska former trots att tydlig slemhinneskada kunnat påvisas, visar sig många i efterhand må bättre efter byte till glutenfri kost [13].
Arvet av stor betydelse
Risken att drabbas av celiaki är ca 15 procent om en annan familjemedlem har sjukdomen. Vidare är risken ca 70 procent för en enäggstvilling att drabbas om den andra har celiaki [14]. Det finns även en koppling till andra sjukdomar; ca 10–20 procent av patienter med celiaki har antingen diabetes, autoimmun tyreoidit, IgA-brist, Downs, Williams eller Turners syndrom [15, 16]. Celiaki är starkt kopplat till HLA-komplexet beläget på den korta armen på kromosom 6 och specifikt till haplotyperna DQ2 eller DQ8 [16]. HLA (humant leukocytantigen) kodar för molekyler som uttrycks på antigenpresenterande celler, vilka i sin tur aktiverar T-hjälparceller i immunförsvaret.
Närmare 90–95 procent av celiakipatienterna är bärare av DQ2 och resterande av DQ8. I kliniken kan därför analys av negativ HLA-typ i princip användas för att utesluta celiaki och risk att utveckla celiaki. Dessa HLA-typer anges vanligen förekomma hos 25 procent av normalbefolkningen, men i Sverige har en förekomst på 53 procent påvisats [17].
De specifika HLA-generna är således nödvändiga för att celiaki ska utvecklas, men endast en mindre andel av bärarna utvecklar sjukdomen. HLA bidrar med endast 35–50 procent av den ärftliga risken för celiaki. Även andra gener har visats kunna ha viss betydelse för utveckling av celiaki, varav de flesta med relation till immunförsvaret [18].
En kronisk sjukdom med autoimmuna drag
Gluten är ett samlingsnamn för proteinfraktionen i vete och kan delas in i glutenin och gliadin. Liknande molekyler finns även i korn och råg. De är unika genom att vara mycket prolin- och glutaminrika, vilket gör dem svåra att bryta ned i mag–tarmkanalen, och stora molekyler når tunntarmen. Gliadiner är skadliga för individer med celiaki, och det är särskilt vissa sekvenser av glutamin som anses ge upphov till skadan i tunntarmsslemhinnan.
Det är i dag allmänt accepterat att celiaki är en kronisk sjukdom med autoimmuna drag som orsakas av ett immunsvar mot gliadin, främst medierade av CD4-positiva T-celler. En trolig förklaringsmodell är att det uppstår en inledande barriärskada i tunntarmens slemhinna, som leder till ökad genomsläpplighet för gliadiner. Frisättning av intracellulärt vävnadstransglutaminas (tTG; tissue transglutaminase) i lamina propria aktiveras i närvaro av höga nivåer av extracellulärt kalcium. Aktivering av tTG leder till en tvärbindningsprocess med gliadin som genom deamidering bildar nya peptider med hög affinitet för HLA-DQ2 och HLA-DQ8 på antigenpresenterande celler, kallat deamiderat gliadin [19].
Nya CD4-positiva T-celler stimuleras därmed och frisätter proinflammatoriska cytokiner, främst interferon-gamma. Då aktiveras makrofager som signalerar till mesenkymala celler, vilka producerar proteaser inblandade i nedbrytningsprocessen av tunntarmens bindväv. På så sätt uppstår i tunntarmsslemhinnan den villusatrofi och krypthyperplasi som är karakteristisk för sjukdomen.
Serologiska markörer för screening och diagnostik
I takt med att olika antikroppar påvisats hos individer med celiaki har nya metoder utvecklats och introducerats i kliniken. Att halten av antikroppar sjunker vid glutenfri kost gör bedömning av antikroppsnivåer värdefull även vid utvärdering av kostbehandlingen. Eftersom celiaki drabbar tunntarmsslemhinnan, där IgA är det viktigaste immunglobulinet, baseras i dag de flesta kliniska metoder på mätning av IgA-antikroppar.
Sensitiviteten för IgA-antikroppar mot gliadin (IgA-AGA) hos barn uppskattas till 84 procent (52–100 procent) och specificiteten till motsvarande 91 procent (83–100 procent). Även om känsligheten för IgA-AGA är något högre hos barn än hos vuxna, är specificiteten alltför låg för att det ska kunna rekommenderas som enda test vid screening av barn i dag [20]. I början av 1980-talet påvisades IgA-antikroppar riktade mot endomysium (IgA-EMA). Med indirekt immunfluorescens uppvisade IgA-EMA både hög sensitivitet och hög specificitet hos barn, motsvarande 96 procent (88–100 procent) respektive 98 procent (90–100 procent), även om IgA-EMA kan vara normalt hos barn under 2 års ålder med celiaki, således lägre sensitivitet [20]. När tTG identifierades senare som autoantigenet för EMA har IgA-antikroppar riktade mot tTG uppvisat en likvärdigt hög sensitivitet på 96 procent (86–100 procent) och specificitet 97 procent (95–100 procent) [21].
Den alternativa radioaktiva mätmetoden, s k radioligandbindningsanalys (RBA), har också uppvisat en god diagnostisk träffsäkerhet med en sensitivitet på 98 procent (96–100 procent) och en specificitet på 99 procent (96–100 procent) [22].
Dessa laborativa metoder baserade på bestämning av IgA-antikroppar kan emellertid inte identifiera celiaki hos individer med selektiv IgA-brist (<0,5 g/l), ett tillstånd som drabbar ca 1/500 av befolkningen. Vid konstaterad selektiv IgA-brist analyseras i stället IgG-tTG, vilket visat sig vara nästan lika tillförlitligt vid celiaki.
Under 2000-talet har utvecklats en ny generation av antikroppstest baserade på syntetiska deamiderade gliadinpeptider (DGP). Dessa s k DGP-antikroppar verkade initialt lovande för barn under 2 års ålder och för dem med IgA-brist. I en svensk prospektiv multicenterstudie har dock IgG-DGP i klinisk praxis inte visat sig ha några fördelar jämfört med att enbart använda IgA-tTG [23].
Nytt vårdprogram – så här fastställs diagnosen
ESPGHAN, den europeiska barngastroenterologiska föreningen (European Society for Pediatric Gastroenterology, Hepatology and Nutrition), kom 2012 med en revidering av rekommendationerna för diagnostik av celiaki [24].
Eftersom det nu kliniskt har säkerställts ett starkt samband mellan nivån av IgA-tTG och graden av tunntarmsskada samt att kraftigt förhöjda nivåer i stort sett alltid påvisar en villusatrofi, innebär de nya rekommendationerna att man vid stark klinisk misstanke om celiaki (dvs förekomst av tydliga symtom och 10-faldigt förhöjda IgA-tTG-nivåer) numera kan välja att avstå från tunntarmsbiopsi för att bekräfta diagnosen.
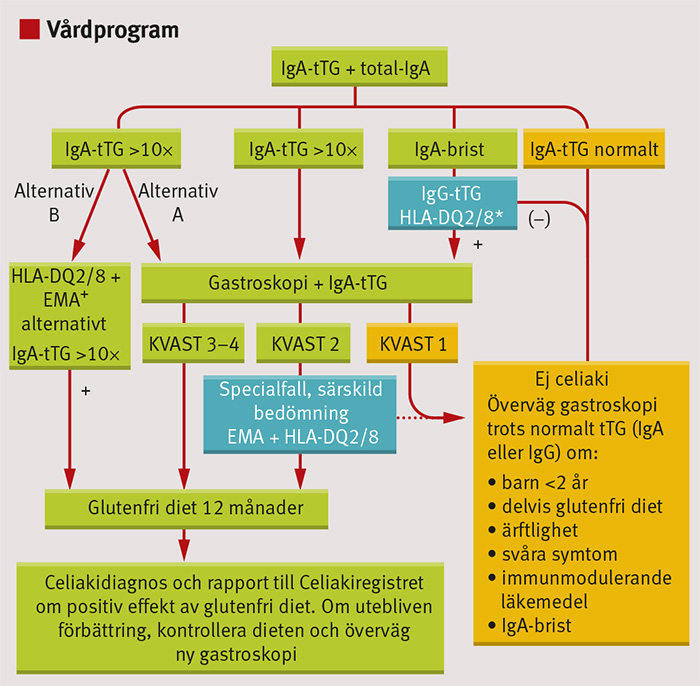
Under 2012 presenterades det nya svenska vårdprogrammet för celiaki hos barn och ungdomar för att följa de nya europeiska rekommendationerna (Figur 3). I denna reviderade version är det första steget för diagnostik hos barn och ungdomar med symtom att alltid analysera IgA-tTG och totalt IgA (det senare för att utesluta IgA-brist). Är nivån av IgA-tTG förhöjd, men under 10 gånger normalvärdet, ska tunntarmsbiopsi utföras, helst med multipla biopsier via gastroskopi eftersom fläckvisa förändringar anses kunna förekomma. Man rekommenderar således fyra biopsier nedom bulbus duodeni samt två biopsier i bulben.
Om IgA-brist konstateras ska i stället IgG-tTG analyseras. Om IgA-tTG (eller IgG-tTG vid IgA-brist) är negativt, är diagnosen celiaki mindre trolig, men inte helt utesluten. Hos barn under 2 års ålder och hos barn med svåra symtom eller under särskilda omständigheter (t ex pågående behandling med immunmodulerande läkemedel) där klinisk misstanke kvarstår trots avsaknad av IgA-tTG (eller IgG-tTG vid IgA-brist) bör tunntarmsbiopsi ändå övervägas.
För att diagnosen ska anses säkerställd ska också en glutenfri kost leda till symtomlindring och IgA-tTG med tiden signifikant reduceras.
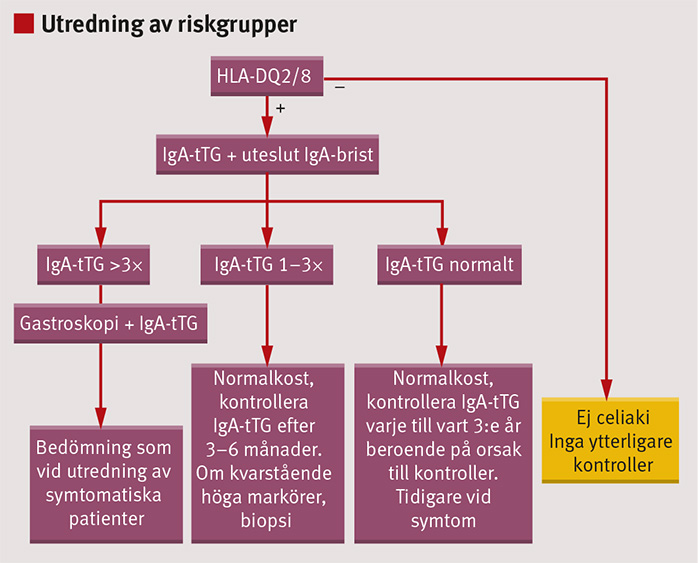
Hos barn och ungdomar med ärftligt ökad risk för celiaki, t ex förstagradssläktingar, rekommenderas blodprovtagning för IgA-tTG. Även barn med typ 1-diabetes, sköldkörtelsjukdom eller andra autoimmuna sjukdomar eller med Downs eller Turners syndrom rekommenderas regelbunden screening för celiaki. Genom att bestämma HLA-typ kan man begränsa upprepad screening för celiaki hos individer med negativt DQ2 och DQ8.
Om förhöjd IgA-tTG-nivå upptäcks via screening hos ett barn som inte uppvisar tydliga symtom, bör tunntarmsbiopsi emellertid alltid utföras. Bakgrunden till denna rekommendation är att det i dessa riskgrupper förekommer individer med måttligt förhöjda nivåer av IgA-tTG (1–3 gånger normalvärdet) utan att tunntarmsskada kan påvisas [25]. Hos dessa individer med s k potentiell celiaki rekommenderas i första hand att man tar ett nytt blodprov efter 3–6 månader. Om IgA-tTG-nivån då fortfarande är förhöjd, rekommenderas vidare utredning med gastroskopi för att utesluta eller bekräfta celiaki (Figur 4).
En befarad risk om barn och ungdomar inte får diagnosen celiaki ställd med eller utan tunntarmsbiopsi via barnmedicinsk klinik är att dessa barn går miste om den information och uppföljning som barnläkare och dietist med erfarenhet av celiaki kan ge. Utan en regelbunden kontinuitet och uppföljning via barnmedicinsk mottagning är vår erfarenhet att följsamheten till en glutenfri diet försämras och risken för framtida komplikationer därmed ökar. Dessutom finns en risk att familjer till barn med celiaki som inte fått diagnos enligt gällande kriterier går miste om möjligheten till ekonomiskt stöd för glutenfria produkter via dietist och även kan gå miste om ekonomisk ersättning från sina försäkringsbolag.
När diagnosen initialt bekräftats antingen serologiskt eller med tunntarmsbiopsi rekommenderas ett uppföljande återbesök till barnläkare och dietist efter ca 3–6 månader för kontroll av tillväxt och följsamhet till glutenfri kost samt provtagning för IgA-tTG (eller IgG-tTG vid IgA-brist) och screening av associerade sjukdomar (med TSH, ASAT och ALAT). Allteftersom barnen blir äldre ökar vikten av att informationen vänder sig till ungdomarna själva så att de blir väl insatta i sjukdomen och förtrogna med att på egen hand sköta glutenfri kost även i vuxen ålder.
Glutenfri kost och socialt stöd
Behandlingen innebär en livslång strikt glutenfri kost, dvs kost fri från vete, råg och korn.
Ren havre anses inte skadlig vid celiaki och kan därför ingå i den glutenfria kosten. En glutenfri kost ger oftast symtomfrihet och tycks skydda mot flera sekundära komplikationer som benskörhet, malignitet, infertilitet, depression etc. Det är emellertid fortfarande oklart huruvida glutenfri kost skyddar individer med celiaki från andra autoimmuna sjukdomar som diabetes och tyreoidit.
Många med celiaki upplever behandlingen som krävande i vardagen trots att det nu i dagligvaruhandeln finns ett allt större utbud av glutenfria ersättningsprodukter. Vi har i studier visat att en del ungdomar upplever det som en avsevärd social uppoffring att försöka hålla en strikt glutenfri kost, till och med socialt stigmatiserande [26, 27]. Erfaret stöd av dietist är centralt vid behandling av barn och ungdomar med celiaki och utgör grunden för fortsatt god följsamhet till kostbehandlingen.
Hälso- och sjukvården bär ansvaret för att behandlingen ges till alla barn och ungdomar med celiaki. Ett kompletterande stöd kan fås av Celiakiförbundet (http://celiaki.se) som är den enda föreningen i Sverige som organiserar denna patientgrupp utanför hälso- och sjukvården och där individer med celiaki kan få ny viktig information om sjukdomen.
Medlemmar i arbetsgruppen för celiaki: Annelie Ivarsson (ordförande), Umeå; Lars Stenhammar (sekreterare), Norrköping; Audur H Gudjónsdóttir, Göteborg; Daniel Agardh, Malmö/Lund; Eva Lindberg, Örebro; Lars Browaldh, Stockholm; Lars Ekstav, Örebro; Lena Grahnquist, Stockholm; Lotta Högberg, Norrköping; Lotta Webb, Malmö/Lund; Marianne Malmqvist, Göteborg; Niklas Nyström, Uppsala; och Olof Sandström, Umeå.
Fakta 1. Symtom och fynd
Symtom och fynd som kan indikera obehandlad celiaki (exempel)
- Buksmärtor och uppblåsthet
- Tarmrubbningar (diarré alternativt obstipation)
- Anemi
- Trötthet
- Ont i kroppen
- Beteenderubbningar
- Koncentrationssvårigheter
- Depression
- Tillväxtrubbning
- Försenad pubertet
- Ökad trötthet
- Frekventa aftösa sår i munhålan
- Tänder med emaljpåverkan
Fakta 2. Fallbeskrivning: Daniel, 15 år
Daniel hade tidigare i huvudsak varit frisk, men i åk 9 drabbades han av en depression utan säker genes. Man sökte barn- och ungdomspsykiatrin (BUP), och antidepressiv medicinering sattes in.
Daniel missade första terminen av åk 1 i gymnasiet, han kunde inte koncentrera sig och fick svårt med inlärningen.
Efter 5–6 månader sökte föräldrarna med pojken på vårdcentral, eftersom han en längre tid också haft IBS-liknande symtom. Utredning påvisade då kraftigt förhöjd IgA-tTG-nivå 75 (referensvärde <7). Diagnosen celiaki ställdes efter gastroskopi.
Efter 3 månaders glutenfri kost var pojken helt återställd avseende depressionen, han hade slutat medicinera, gick i skolan på heltid och fick bra betyg efter åk 1.






![Figur 2. Den svenska epidemin av celiaki med tidpunkterna för ändrad kostrekommendation indikerade [5, 6].](https://lakartidningen.se/wp-content/uploads/EditorialFiles/Y3/%5bCMY3%5d/2013-0043_2_webb.jpg)