Primärbehandling av epitelial ovarialcancer är radikal kirurgi följd av adjuvant kemoterapi med karboplatin och paklitaxel.
Behandlingsplanering vid multidisciplinär konferens och centralisering till tumörkirurgiska centra ger bättre kvalitet på kirurgi och bättre överlevnad.
Bevacizumab ges i primärbehandlingen som tillägg vid icke-operabel avancerad epitelial ovarialcancer.
Underhållsbehandling med PARP-hämmaren olaparib rekommenderas till patienter som svarat på platinainnehållande kemoterapi för sent återfall av BRCA-muterad höggradig serös epitelial ovarialcancer.
Patienter med platinaresistent recidiv bör få tillägg med bevacizumab till kemoterapi.
Alla patienter med epitelial ovarialcancer bör, oavsett familjehistoria, erbjudas genetiskt test.
Epitelial ovarialcancer är den mest dödliga gynekologiska cancersjukdomen och utgör >90 procent av maligna ovarialtumörer. Medelåldern i Sverige är 65 år vid insjuknandet. Stadieindelningen är kirurgisk och görs enligt FIGO (International Federation of Gynecology and Obstetrics)-klassifikationen [1] (Tabell I). Majoriteten av kvinnor med epitelial ovarialcancer diagnostiseras med stadium III–IV.
Syftet med denna artikel är att redovisa de för närvarande använda behandlingsmodaliteterna vid epitelial ovarialcancer. Tubar- och peritonealcancer handläggs, stadieindelas och behandlas på likartat sätt som epitelial ovarialcancer och inkluderas därför i denna översikt.
Kirurgisk behandling
Kirurgin vid epitelial ovarialcancer var fram till 1970-talet baserad på explorativ kirurgi för i huvudsak fastställande av diagnos. Det ansågs allmänt inte lönsamt, eller ens kirurgiskt tekniskt möjligt, att ta bort all makroskopisk (inget för ögat synlig) cancer i buken vid avancerad sjukdom, eftersom prognosen ändå var så dålig och risken för postoperativa komplikationer hög. Genombrottet för den kirurgiska utvecklingen kom efter CT Griffiths banbrytande publikation 1975, där han beskrev att överlevnaden i epitelial ovarialcancer var signifikant bättre om man använde kraftfull tumörreducerande kirurgi så att den kvarvarande tumörbördan vid avancerad cancer kunde reduceras till <1,5 cm i den enskilt största diametern [2].
Den radikala extensiva kirurgin hade dock sitt pris i form av hög perioperativ morbiditet och mortalitet [3-5]. Av den anledningen dröjde det flera decennier innan konceptet med radikal kirurgi slog igenom internationellt. Under tiden utvecklades den kirurgiska tekniken och det perioperativa omhändertagandet.
Trots bristen på randomiserade kirurgiska studier finns det numera övertygande resultat från stora retrospektiva studier för att rekommendera ultraradikal kirurgi vid avancerad epitelial ovarialcancer [6-15]. Studierna visar att patienter med kvarlämnad tumörbörda med tumörrester <1 cm som största mått har bättre överlevnad än patienter med större kvarlämnade tumörbördor. Den största vinsten i överlevnad har dock kvinnor som blir makroskopiskt tumörfria vid operationen (Figur 1) [9].
Multidisciplinär konferens
I dag skräddarsys behandlingen av epitelial ovarialcancer i det enskilda fallet vid en multidisciplinär konferens där specialister inom gynekologisk onkologi, gynekologisk tumörkirurgi, bilddiagnostik och patologi, samt vid behov även andra specialister, deltar. Konferensen föregås av omfattande bilddiagnostisk och klinisk utredning. Kirurgin bör centraliseras till de regionala tumörkirurgiska centra där man har certifierade gynekologiska tumörkirurger och hög operationsvolym [16], eftersom detta förbättrar kirurgins kvalitet och förlänger patientens överlevnad [9, 17-22].
Primär radikal kirurgi och ultraradikal kirurgi
Omfattningen av kirurgin är beroende av i vilket stadium sjukdomen diagnostiseras. FIGO-stadium I anses vara tidigt stadium; övriga stadier (FIGO-stadium II–IV) klassas som avancerade stadier, som kräver mer omfattande primär kirurgi med målsättning att uppnå makroskopisk radikalitet. Primär kirurgi i tidigt stadium har till syfte att uppnå makroskopisk radikalitet och att fastställa eventuell spridning. Radikal kirurgi omfattar bilateral salpingooforektomi, total hysterektomi, omentektomi, appendektomi och multipla provexcisioner från peritoneum i hela bukhålan inklusive diafragmakupolerna. Dessutom tas buksköljvätska för cytologisk analys vid operationsstart för att detektera förekomst av cancerceller.
Spridning till de pelvina och paraaortala lymfkörtlarna förekommer i upp till 10–25 procent i »till synes tidigt stadium«, varför lymfkörtelutrymning görs för att fastställa att det de facto rör sig om tidigt stadium. Mikroskopisk spridning i lymfkörtlarna innebär uppgradering till stadium III (Tabell I). Vid vissa histologiska typer är risken för spridning till lymfkörtlarna så liten i tidigt stadium att lymfkörtelutrymning inte behövs. Många gånger är diagnosen ovarialcancer ett överraskningsfynd vid operation av en till synes lokaliserad och benign ovarialcysta/-förändring. När diagnosen epitelial ovarialcancer verifierats histologiskt görs vanligen radikal kirurgi och stadieindelning vid en andra operation på ett gynekologiskt tumörkirurgiskt centrum.
Vid de avancerade stadierna är det främsta syftet att avlägsna all synlig tumörvävnad. Inför operation utreds patienten därför extensivt med bilddiagnostik för att optimalt planera avancerad kirurgi med olika kirurgspecialiteter eventuellt inkopplade. De bilddiagnostiska metoder som används i dag ger god information om större tumörförändringar. Små tumörförändringar på några millimeter syns dock inte på konventionell datortomografi, magnetresonanstomografi (MRT) eller ultraljud, vilket gör det svårt att preoperativt avgöra huruvida ultraradikal kirurgi är möjlig. En kvalificerad värdering görs preoperativt för att skatta kvinnans medicinska status (allmäntillstånd, samsjuklighet etc) och tumörutbredningen för bedömning av om hon klarar extensiv bukkirurgi med dess ganska ofta komplexa postoperativa vårdförlopp. Kirurgin och dess omfattning inklusive konsekvenser och risker bör diskuteras noggrant med patienten och hennes anhöriga inför operation.
För att uppnå makroskopisk radikalitet vid avancerad sjukdom kan tarmresektion, splenektomi, omfattande peritonealresektion, kolecystektomi och borttagande av förstorade lymfkörtlar samt resektion av diafragma och eventuellt pleura behöva utföras, i undantagsfall även pankreas- eller leverresektion. Vid dessa ingrepp behövs hög kirurgisk kompetens med många års erfarenhet av gynekologisk tumörkirurgi i kombination och samarbete med andra kirurgiska specialiteter. Det postoperativa förloppet är ofta komplicerat med en rapporterad peri- och postoperativ mortalitet på 0,3–5,7 procent och morbiditet på 3,7–59 procent [23, 24], varför högkompetent anestesi- och intensivvård och postoperativ vård behövs.
Fertilitetsbevarande kirurgi
Cirka 8 procent av epitelial ovarialcancer i FIGO-stadium I diagnostiseras hos kvinnor <40 år. Frågan om fertilitetsbevarande kirurgi är därför viktig. De viktiga frågeställningarna kring prognos avseende cancersjukdomen, risken för återfall vid icke-radikal kirurgi och onkologisk behandling samt graviditetsmöjligheter bör diskuteras ingående med kvinnan och hennes familj. Fertilitetsbevarande kirurgi bör begränsas till kvinnor med mycket starka önskemål om bevarad fertilitet och med epitelial ovarialcancer i tidigt stadium med »gynnsam« histologi. Kirurgin utförs på samma sätt som den radikala kirurgin, dvs som ett konventionellt kirurgiskt stadieindelningsingrepp, frånsett att uterus och minst den ena äggstocken lämnas kvar. Lymfkörtelutrymning utförs i dessa fall även när det finns maligna celler i buksköljvätskan eller om ovarialcystan med cancern har brustit eller brister under ingreppet.
Det har inte publicerats några prospektiva studier angående fertilitetsbevarande kirurgi vid epitelial ovarialcancer i tidigt stadium med »gynnsam« histologi. Rekommendation om fertilitetsbevarande kirurgi baseras på en systematisk översikt och retrospektiva studier [25, 26]. Det vetenskapliga underlaget är sålunda begränsat, och rekommendationen måste göras individuellt och med försiktighet.
Kirurgi vid recidiv
Långtidsprognosen för patienter med recidiv av epitelial ovarialcancer är generellt dålig, men utsikterna på kort och medellång sikt har förbättrats avsevärt. Behandling av recidiv sker i huvudsak med kemoterapi. Kirurgi vid recidiv av sjukdomen har ett palliativt syfte för att lindra eller förebygga symtom och i bästa fall förlänga överlevnaden. Det finns begränsat vetenskapligt underlag från retrospektiva studier för att överlevnaden förlängs om man vid ett recidiv kan göra sekundär kirurgi med makroskopisk radikalitet [27]. Studier har visat att sekundär kirurgi kan ge effekt på överlevnaden om det gått >6 månader efter avslutad primärbehandling med kemoterapi [28, 29].
Kvinnor med tumörprogress under pågående kemoterapi eller inom 6 månader efter avslutad kemoterapi har mycket sämre prognos. Det finns ingen påvisad vinst av att göra fler försök till kirurgisk tumörreduktion hos dessa kvinnor om primäroperationen har utförts av erfaren gynekologisk tumörkirurg [30].
Recidiv av epitelial ovarialcancer ger ofta symtom på tarmobstruktion, och avlastande enterostomi, enteroanastomos eller perkutan gastrostomi i palliativt syfte bör då övervägas. Studier av kirurgi vid recidiv behövs för att fastställa vad som är bäst, och flera randomiserade studier pågår [31, 32].
Medicinsk onkologisk behandling
Kemoterapi
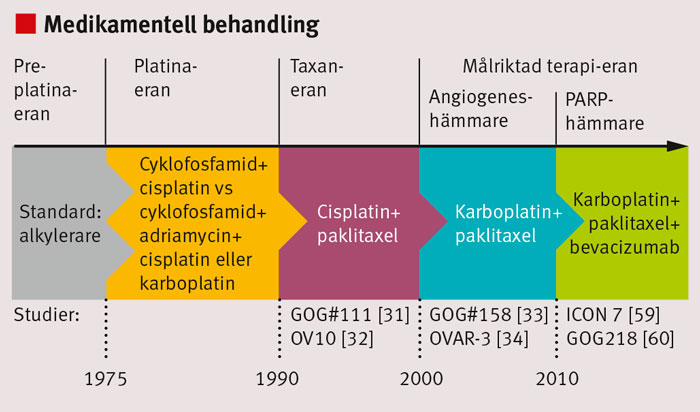
Med undantag för lokaliserad epitelial ovarialcancer i tidigt stadium med »gynnsam« histologi och låg risk för recidiv samt god prognos, vid vilken standardbehandlingen är kirurgi efterföljd av observation, är kemoterapi grundstenen i primär- och recidivbehandling av epitelial ovarialcancer. Platinabaserad kemoterapi med karboplatin och paklitaxel intravenöst är standardkombinationen vid avancerad epitelial ovarialcancer (Figur 2) [33-36]. Studierna har inkluderat alla histologiska undergrupper, men fall av höggradig serös epitelial ovarialcancer har dominerat. Även om känsligheten för kemoterapi skiljer sig mellan höggradig serös och övriga fyra undergrupper (låggradig serös, endometrioid, klarcellig och mucinös) rekommenderas därför, än så länge, samma behandling.
I första hand bör dessa patienter erbjudas behandling inom riktade studier. Vid avancerad sjukdom ges 6 cykler med karboplatin och paklitaxel. Med denna behandlingsstrategi är progressionsfri medianöverlevnad ca 20 månader och total medianöverlevnad nära 5 år.
Flera studier har de senaste 15 åren utförts för att utvärdera andra platinakombinationer i dubbletter, tripletter och som sekventiell behandling men utan påvisad bättre effekt än kombinationen karboplatin och paklitaxel [37-44]. Doseskalering av kemoterapi (högdosbehandling) har inte varit framgångsrik [45].
Neoadjuvant kemoterapi
I selekterade fall vid avancerad sjukdom kan kemoterapi ges före kirurgi, s k neoadjuvant kemoterapi. Vilken roll neoadjuvant kemoterapi har vid avancerad epitelial ovarialcancer debatteras. Två randomiserade studier som jämfört neoadjuvant kemoterapi med primär kirurgi vid stadium III–IV har inte påvisat någon skillnad i överlevnad; däremot var allvarlig postoperativ morbiditet respektive mortalitet lägre vid neoadjuvant kemoterapi än vid primär kirurgi [46, 47].
Studierna har dock kritiserats på grund av metodologiska brister, framför allt avseende den kirurgiska skickligheten. I gruppen som genomgick primärkirurgi uppnåddes makroskopisk radikalitet hos i genomsnitt <20 procent. Vid större centra med erfarna tumörkirurger bör, enligt internationell konsensus, andelen som opereras till makroskopisk radikalitet vid primärkirurgi vara minst 50 procent. Det måste samtidig påpekas att nyttan av ultraradikal kirurgi jämfört med »standardkirurgi« inte har studerats inom randomiserade studier, varför resultaten av studierna av neoadjuvant kemoterapi är svåra att tolka och generalisera.
I Sverige rekommenderas i dag neoadjuvant kemoterapi vid icke-operabel sjukdom i stadium IIIC–IV [16]. Vid god tumörrespons utförs fördröjd primär kirurgi, följd av ytterligare 3 kurer kemoterapi. Syftet med fördröjd primärkirurgi är att uppnå makroskopisk tumörfrihet. Skörhet på grund av ålder, samsjuklighet och allmäntillstånd kan omöjliggöra ett radikalt kirurgiskt ingrepp, och i dessa fall förordas palliativ kemoterapi.
Platinafritt intervall och kemoterapi vid recidiv
Behandlingsvalet vid recidiv av epitelial ovarialcancer baseras på längden av det behandlingsfria intervallet efter senaste givna platinabaserad kemoterapi fram till recidiv. Ju längre intervall, desto större sannolikhet för att tumören återigen svarar på samma behandling [48]. Platinabaserad kombinationsbehandling ges vid recidiv med behandlingsfritt intervall >6 månader. Karboplatin kan kombineras med paklitaxel [49], gemcitabin [50] eller pegylerat liposomalt doxorubicin [51] med hänsyn till besvär och samsjuklighet. Ett nytt alternativ vid behandlingsfritt intervall >6 månader är kombinationen pegylerat liposomalt doxorubicin och trabektidin [52].
Hos i princip alla patienter med recidiv av epitelial ovarialcancer utvecklas med tiden platinaresistent sjukdom, men i denna situation är sjukdomen påtagligt heterogen vad gäller både kliniskt förlopp och molekylära karakteristika. Vanligen ges då monoterapi med främst pegylerat liposomalt doxorubicin eller veckovis behandling med paklitaxel. Randomiserade studier rapporterar i denna grupp snarlik progressionsfri medianöverlevnad på 3–4 månader och total medianöverlevnad på omkring 12 månader oavsett behandlingsalternativ [53].
Dostät kemoterapi med veckovis paklitaxel
Paklitaxel utövar sin maximala celldödande effekt på celler i aktiv celldelning och orsakar cellcykelarrest vid G2/M-kontrollen. Motivet bakom att ge paklitaxel varje vecka är att utnyttja andra antitumorala mekanismer, t ex antiangiogenes och induktion av apoptos [54, 55]. Flera randomiserade studier har utvärderat dostät paklitaxelbehandling veckovis tillsammans med karboplatin i primärbehandling [56-58]. Resultaten varierar från signifikant förbättrad progressionsfri medianöverlevnad [56] till ingen skillnad [57], möjligen på grund av att olika doser paklitaxel har använts i studierna.
I väntan på resultatet av den pågående brittiska 3-armade studien [58] ingår veckovis paklitaxel med karboplatin var 3:e vecka i behandlingsarsenalen vid primärbehandling av epitelial ovarialcancer [16].
Intraperitoneal kemoterapi
Genom att ge kemoterapi direkt i bukhålan, intraperitonealt, kan den peritoneala läkemedelsexponeringen ökas många gånger. Adekvat koncentration i cirkulationen bibehålls genom absorption via lymfkärl och sårytor efter peritonektomi. Intraperitoneal behandling förlänger såväl progressionsfri medianöverlevnad som total medianöverlevnad hos patienter med stadium III med minimal resttumör i buken efter primär kirurgi [59].
Statens beredning för medicinsk och social utvärdering, SBU, framhåller i en kommentar att det fortfarande finns viss osäkerhet om metodens kliniska nytta [60]. En orsak är att inga direkta jämförelser har gjorts med dagens standardterapi, en annan den ökade risken för allvarliga biverkningar och en tredje orsak är osäkerheten om huruvida effekten beror på den intraperitoneala administreringen i sig eller inte. Ytterligare tre randomiserade studier pågår för att besvara denna frågeställning.
Hypertermisk intraperitoneal kemoterapi har utvecklats av kirurger vid operation av icke-gynekologisk peritoneal karcinomatos, framför allt vid kolorektal cancer. Hypertermi ökar tumörers blodtillförsel och syresättning, vilket kan öka absorption och känslighet för kemoterapi. Vid hypertermisk intraperitoneal kemoterapi ges uppvärmda cytostatika peroperativt direkt in i bukhålan. De studier som publicerats har främst varit retrospektiva, men flera randomiserade studier pågår [61]. Det finns inga randomiserade studier av epitelial ovarialcancer som visar förbättrad progressionsfri eller total medianöverlevnad, varför hypertermisk intraperitoneal kemoterapi inte rekommenderas utanför studier vid epitelial ovarialcancer [62].
Målriktad terapi
Ny kunskap om molekylära karakteristika i de olika histologiska undergrupperna av epitelial ovarialcancer har öppnat för nya läkemedel, riktade mot specifika målmolekyler.
Angiogeneshämmare. Angiogenes, nybildning av blodkärl, är viktig för tillväxt och spridning av solida tumörer, särskilt epitelial ovarialcancer. Vaskulär endoteltillväxtfaktor (VEGF) utsöndras av tumörceller och spelar en viktig roll för angiogenesen. Bevacizumab, en monoklonal antikropp som binder till VEGF-A, har studerats mest vid epitelial ovarialcancer, vid såväl primär- som recidivbehandling.
I en multinationell randomiserad studie visades att kvinnor med avancerad sjukdom som erhållit primärbehandling med tillägg av bevacizumab och därefter monoterapi i 12 månader, hade förlängd progressionsfri medianöverlevnad jämfört med kontrollgruppen [63]. I en högriskgrupp var skillnaden 4,1 månader och för total medianöverlevnad 4,8 månader [64]. I den amerikanska studien GOG218 resulterade motsvarande regim i förbättrad progressionsfri medianöverlevnad men ingen skillnad i total medianöverlevnad [65]. Bevacizumab har godkänts för primärbehandling med karboplatin och paklitaxel följd av underhållsbehandling i 15 månader för patienter med epitelial ovarialcancer i stadium III–IV med resttumör efter kirurgi eller inoperabel tumör.
Vid recidiv har tillägg av bevacizumab till kemoterapi utvärderats i två studier och visat förbättrad progressionsfri men inte total medianöverlevnad [66, 67]. I båda studierna förekom hög andel oplanerade byten till bevacizumab, vilket försvårar tolkningen av data avseende total medianöverlevnad.
Resultaten av dessa fyra studier har inneburit ett genombrott för målriktad terapi och angiogeneshämning vid epitelial ovarialcancer. Risken för de välkända biverkningarna hypertoni, blödning, tromboembolism och gastrointestinala perforationer och fistlar måste beaktas.
I flera randomiserade studier rapporteras positiva resultat av angiogeneshämmare riktade mot andra målmolekyler [68-70]. Positiva resultat rapporteras vid behandling med trebananib riktad mot angiopoetin 1 och 2 i kombination med veckovis paklitaxelbehandling vid recidiv [71].
PARP-hämmare. Enkelsträngsbrott på DNA sker ständigt i normala celler, och PARP (poly-[ADP-ribos]polymeras) upptäcker och reparerar dessa med »base excision repair«. Om PARP hämmas kan skador som inte repareras omvandlas till dubbelsträngsbrott. Dubbelsträngsbrott repareras huvudsakligen via homolog rekombination (HR). Mutationer i BRCA-generna resulterar i defekt DNA-reparation med homolog rekombination (HRD). Kliniska studier med PARP-hämmare har visat exceptionellt goda resultat vid behandling av patienter med ärftliga BRCA-mutationer. Normala celler med intakt DNA-reparation påverkas inte.
PARP-hämmaren olaparib är nyligen godkänd som underhållsbehandling till patienter som svarat på platinainnehållande kemoterapi för sent återfall av BRCA-muterad höggradig serös ovarial-, tubar- eller primär peritonealcancer. Godkännandet baseras på resultaten av en randomiserad fas 2-studie med 265 patienter som svarat på platinabaserad recidivbehandling och därefter erhållit olaparib, eller placebo, som underhållsbehandling [72]. I studien hade 51 procent av patienterna BRCA-mutation. Den bästa effekten av olaparib observerades hos patienter med ärftlig BRCA-mutation, och risken för tumörprogress minskade med 82 procent [73]. Data för analys av total medianöverlevnad är ännu inte klara. Effekt observerades även i gruppen med vildtyps-BRCA.
Resultaten är ett genombrott för individualiserad behandling vid epitelial ovarialcancer. Ytterligare studier krävs för att utvärdera om indikationen kan utvidgas till alla tumörer med HRD. Andra PARP-hämmare som utvärderas i randomiserade studier vid såväl primär- som recidivbehandling av epitelial ovarialcancer är niraparib, veliparib och rucaparib.
Andra målriktade behandlingar. En helt ny behandlingsstrategi vid höggradig serös ovarial-, tubar- eller primär peritonealcancer är att kombinera angiogeneshämmare med PARP-hämmare utan kemoterapi. Lovande resultat har rapporterats vid platinakänsligt recidiv [74]. Övriga undergrupper av epitelial ovarialcancer, med mutationer i andra gener än p53 och BRCA, svarar sämre på kemoterapi. Utveckling av målriktade läkemedel för dessa tumörer är av speciellt stort intresse, och flera studier pågår [53, 75, 76].
Vid epitelial ovarialcancer är immunterapi (t ex PD-L1-hämmare) en annan spännande behandlingsstrategi under stark utveckling [77].
Potentiella bindningar eller jävsförhållanden: Pernilla Dahm Kähler har erhållit arvode för föreläsning från Roche, Merck AB och Astellas Pharma. Bengt Tholander är huvudprövare/prövare i studier från Roche, Glaxo, Boehringer Ingelheim, Bristol-Myers Squibb, MSD, Amgen och Array BioPharma. Elisabeth Åvall Lundqvist har erhållit arvode för konsultuppdrag och föreläsning från Roche, Boehringer Ingelheim, MSD och AstraZeneca.





![Figur 1. Betydelse av kirurgisk radikalitet för total överlevnad vid epitelial ovarialcancer. Efter: du Bois et al [9] (publiceras med tillstånd från John Wiley and Sons).](https://lakartidningen.se/wp-content/uploads/EditorialFiles/UF/%5bDLUF%5d/2015-038_01_webb.jpg)