Bästa praxis (bästa möjliga vård) för en väldefinierad patientgrupp vägleds av den aktuella evidensbasen (den vetenskapliga bakgrunden) och rekommendationsunderlaget (balansen nytta/skada).
Beslut om vård för enskilda patienter bör baseras på bästa praxis i kombination med kliniska överväganden, lokala förutsättningar och patientens preferenser.
Studier visar att mer än var tredje patient som vårdas på sjukhus inte får vård i enlighet med bästa praxis.
En god följsamhet till bästa praxis leder till förbättrad vårdkvalitet (förbättrad överlevnad, färre komplikationer och färre återinläggningar på sjukhus) och mer effektiv vård.
Vården kan förbättras påtagligt genom att resurser avsätts för att systematiskt ta fram, sprida, tillämpa, mäta och analysera bästa praxis.
Medicinska paradigm har en tendens att samlas under mer eller mindre lättfattliga begrepp. De senaste decennierna har paradigmen »evidens« och »kvalitet« dominerat [1]. Paradigmet skiftar nu mot »värde«. Naturligtvis ersätter inte de begreppsmässiga innehållen i paradigmen varandra utan ska snarare ses som en utveckling där nya idéer och begrepp omfattar och bygger vidare på de gamla [2]. Vi vill med denna artikel lyfta fram betydelsen av att arbeta med evidens och bästa praxis (best practice), det vill säga bästa möjliga vård, i den värdeskapande vårdprocessen.
Personer som inte arbetar inom sjukvården har i allmänhet förståelse för att sjukvård är komplext och att komplikationer kan inträffa. Vad man däremot blir förvånad över att höra är att det förekommer vård som inte är uppdaterad och inte bedrivs i enlighet med aktuell vetenskaplig evidens.
En uppmärksammad undersökning av den oberoende forskningsorganisationen Rand Corporation visade att endast drygt hälften (55 procent) av patienterna inom olika specialiteter fick en vård som var förenlig med väletablerad evidens [3]. Andra beräkningar har visat att 30–40 procent av patienterna inte får en vård som är i överensstämmelse med nationella riktlinjer eller bästa vetenskapliga evidens och att 20–25 procent av vården kan betecknas som onödig eller utan värde [4]. Stora skillnader mellan evidens och hur vården bedrivs finns dokumenterade för många olika specialiteter [5-7] och åtgärder, till exempel trombos- [8] och infektionsprofylax [9] och radio- [10] och kemoterapi [11]. Ökad följsamhet till bästa praxis är angelägen eftersom det ger en högre vårdkvalitet (förbättrad överlevnad, färre komplikationer, färre återintag på sjukhus, kortare vårdtider) [5, 12] och bättre resursutnyttjande [13, 14], och därmed ger vården ett ökat värde.
Skillnader i hur olika vårdgivare tillämpar aktuell evidens för likartade patienter är en viktig anledning till oönskad variation i vården. Öppna jämförelser av hälso- och sjukvården i Sverige [15] talar sitt tydliga språk vad gäller variationer mellan olika sjukhus och/eller regioner. För många åtgärder är variationen 2–3 gånger men det finns exempel på 25–50 gångers variation. Variationer har karaktäriserats som onda eller goda [16], där de sistnämnda skillnaderna gäller patienternas behov eller önskemål. Onda variationer kan bland annat bero på att olika vårdgivare tillämpar evidensen olika, på skillnader i tillgång till diagnostiska instrument eller operationer/ingrepp eller på missriktade ekonomiska krafter [17]. Andra vanliga orsaker till avsteg från bästa praxis utgörs av okunskap, kommunikationsproblem, glömska, stress, brister i arbetsledning etc [18].
Bästa praxis vägleds av den aktuella evidensbasen (den vetenskapliga bakgrunden) och rekommendationsunderlaget (balansen nytta/skada). Begreppet bästa praxis relaterar till den struktur och de processer inom vården som har visat sig ge bästa möjliga utfall, en mer förutsebar och jämn kvalitet och som medför den mest verkningsfulla och effektiva vården [19]. Bästa praxis är applicerbar för avgränsbara patientgrupper, diagnoser eller symtom och är den vård som de flesta patienter bör erbjudas eftersom den har bäst förutsättningar att göra nytta för dem. Bästa praxis är i praktiken applicerbar för en majoritet av patienter inom en avgränsbar diagnos, ett sjukdomsstadium eller en sjukdomsfas.
Med undantag för ett begränsat antal åtgärder (till exempel trombosprofylax inför höftplastik) är fullständig följsamhet (100 procent) till bästa praxis vare sig möjlig eller önskvärd. Den utgör en idealsituation – en riktlinje – där avsteg ska göras när patientens sjukdomsbild, förutsättningar eller preferenser så kräver. Så kan fallet vara för en patient med multipla sjukdomar där optimala behandlingsstrategier för enskilda sjukdomar inte kan följas utan risk för allvarliga biverkningar i relation till patientens sammantagna tillstånd [20]. På Intermountain Healthcare i Utah, där man sedan lång tid arbetar med evidensbaserade riktlinjer, kräver man att vårdgivarna följer bästa praxis men gör avsteg när så behövs och rapporterar anledningen till detta, i syfte att på systemnivå lära och utveckla aktuella riktlinjer [21].
Applikationen av bästa praxis bygger på olika typer av kunskap:
- Kunskap framtagen genom forskning (vetenskaplig evidens).
- Kunskap tillkommen genom erfarenhet (läkekonst).
- Kunskap baserad på mätningar av uppnådda resultat (statistik).
Dessa olika typer av kunskap måste integreras med varje patients behov, förutsättningar och önskemål inför beslut om hur den diagnostiska processen ska drivas och vilken behandling som kan komma ifråga.
Kunskap baserad på vetenskap
Medicinsk vetenskap har sedan mitten av 1900-talet genomgått en fenomenal utveckling. Mängden medicinsk kunskap ökar exponentiellt, och det är en stor utmaning att hålla sig uppdaterad. Man har karaktäriserat dagens ökande medicinska informationsmängd med termer som informationsöverflöd, informationsflod eller bibliometrisk explosion – termer som för tankarna till naturkatastrof och hjälplöshet. Det publiceras ca 750 000 nya artiklar per år, och totalt finns fler än 24 miljoner artiklar i den medicinska databasen Medline. Antalet artiklar som läggs in i Medline fördubblas ungefär var tionde år [22], och halveringstiden på relevant klinisk information kan anges till ca 5 år baserat på hur ofta kliniska behandlingsguider uppdateras [23]. Vidare har man beräknat att det finns fler än 13 000 kända sjukdomar och 25 000 medicinska tidskrifter, varav de flesta uppvisar en tilltagande subspecialisering. Problemet är dock inte att det finns för mycket information utan snarare att många som arbetar inom vården saknar en strategi för att på ett effektivt sätt kunna utnyttja den värdefulla information som finns. För att definiera bästa praxis är det således viktigt att identifiera, samla och kritiskt granska vetenskapliga studier [19]. Vi har en enorm mängd kunskap i vår omgivning, men vi har problem med att hålla oss uppdaterade och med att utrangera (utöva »de-innovation« eller »exnovation« av) åtgärder som inte (längre) tillför ett bästa möjliga patientvärde [24].
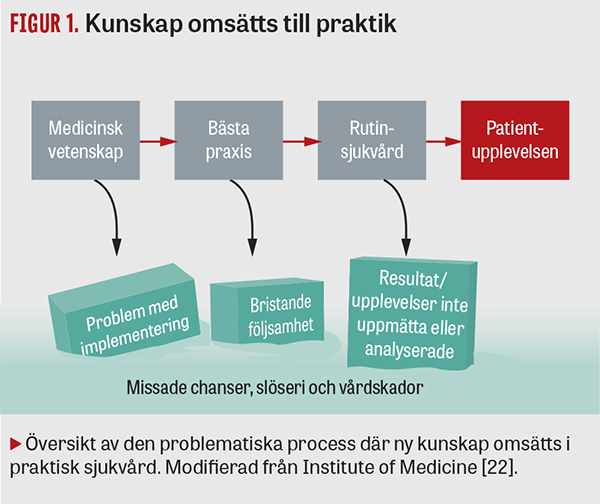
Den så kallade translationen av ny medicinsk kunskap till praktisk sjukvård och förbättrat utfall för patienterna är en långsam process som är kantad av utmaningar, vilka sammantagna visar sig i form av missade chanser, slöseri och vårdskador (Figur 1).
Välgjorda randomiserade studier och metaanalyser kommer högst upp i evidenshierarkin för att värdera nyttan av olika behandlingsalternativ. Före tillämpning behöver man dock bedöma betydelsen av eventuella svagheter i studiernas design, validitet, reliabilitet, generaliserbarhet (överförbarhet), uppföljningstidernas längd och begränsningar vad gäller omfattningen och relevansen av utfallsmåtten. Trots den stora volymen forskning är tillgången till vetenskaplig evidens ojämn – på många områden saknas fortfarande tillräckligt kunskapsunderlag. I en undersökning [25] fann man att beslut som togs av en grupp barnkardiologer till 80 procent saknade grund i vetenskaplig evidens. En svensk undersökning utförd för 15 år sedan fann att 50 procent av vården inom invärtesmedicin byggde på randomiserade studier [26], men hur situationen ser ut i dag är okänt.
Kunskap baserad på klinisk erfarenhet
Historiskt sett var praktiserandet av medicin ett rent hantverk som innebar att yrket lärdes genom att erfarna läkare instruerade nästa generation läkare. Detta skapade i många fall lokala traditioner där indikationer och behandlingar kunde variera mellan olika kliniker eller regioner. Många kom att uppfatta den egna handläggningen som »den enda vägen« där lärande från egna respektive andras misstag och problemlösande var viktiga för att utveckla den egna kompetensen. Det var därför inte konstigt att användningen av diagnostiska metoder, behandlingsmetoder och behandlingsresultat varierade mellan olika läkare och sjukhus. Sådana variationer var i många fall tecken på kvalitetsproblem. Att den egna erfarenheten har sina begränsningar konstaterades redan av Hippokrates: »Livet är kort, konsten lång, tillfället flyktigt, erfarenheten bedräglig.« Klinisk erfarenhet är emellertid fortsatt central för att bedriva god sjukvård och utgör grunden för många, kanske de flesta, medicinska beslut.
Kunskap från kvalitetsmätningar
De nationella kvalitetsregistren (www.kvalitetsregister.se) liksom lokala, diagnos- och specialitetsspecifika kvalitetsregister är viktiga kunskapskällor. Många struktur-, process- och utfallsmått i registren har sitt ursprung i vetenskapligt framtagen evidens, och det finns många studier som visar att en god följsamhet till vetenskaplig evidens ger bättre utfall [12, 27]. Lokala mätdata är viktiga för det egna lärandet och som underlag för kvalitetsförbättring men är sannolikt en underutnyttjad resurs [28].
Den kliniska applikationen av bästa praxis
Kliniska beslutsstöd är viktiga för att vägleda kliniker om hur god vård kan bedrivas. Det finns många nationella och specialitetsanknutna beslutsstöd av god kvalitet där de bästa har såväl evidens- som rekommendationsgraderats. Gradering av evidensens kvalitet bygger på underliggande studiers validitet och reliabilitet. Ju bättre evidenskvalitet, desto mer kan man lita på slutsatserna. Det finns olika modeller och graderingssystem för att bedöma evidensens kvalitet. GRADE (»Grading of Recommendations Assessment, Development and Evaluation«) [29] används av många organisationer, till exempel SBU och Socialstyrelsen.
Att många rekommendationer inte är explicit förankrade i vetenskaplig evidens är dock problematiskt såväl av kvalitets- som trovärdighetsmässiga skäl. I en studie av evidensunderlaget som används av den ansedda kliniska behandlingsguiden SIGN från Skottland fann man att endast hälften av 2 000 rekommendationer för 42 olika diagnoser var baserade på en god vetenskaplig evidens [30].
Den praktiska processen att arbeta med bästa praxis omfattar flera steg: 1) ta fram evidens- och rekommendationsgrad för den aktuella vårdprocessen, 2) skapa en kollegial konsensus om bästa praxis samt 3) införa bästa praxis.
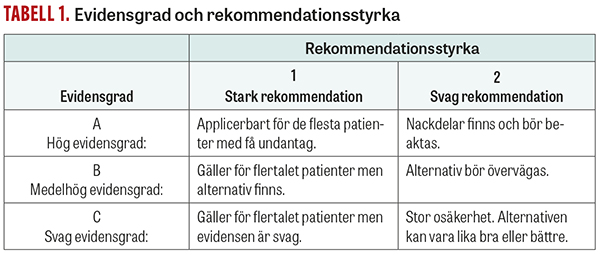
Evidensgraden visar i vilken utsträckning vi kan lita på att den effekt som observerats i vetenskapliga studier är sann (det vill säga studiernas tillförlitlighet). Den bedöms utifrån studiernas interna validitet (risk för så kallad bias), bortfall, studiedesign, uppföljningstid med mera.
Rekommendationsstyrkan avspeglar relationen mellan förväntade positiva och negativa kliniska effekter.
En förenklad variant av GRADE [29, 31] som kombinerar evidens- och rekommendationsstyrka, använder sig av tre evidensnivåer:
- A = hög vetenskaplig evidens som bygger på metaanalyser eller stora välgjorda randomiserade kontrollerade studier.
- B = måttlig evidens som bygger på små eller inte optimalt utförda randomiserade kontrollerade studier eller på studier utan randomisering (kohortstudier, fall–kontrollstudier eller tvärsnittsstudier).
- C = låg vetenskaplig evidens som anges för expertutlåtanden, konsensusrapporter, fallbeskrivningar och andra deskriptiva studier.
Rekommendationens styrka är en bedömning av balansen mellan fördelarna (nyttan) och nackdelarna (skadan) av en behandling eller åtgärd:
- Rekommendationsstyrka 1: fördelarna >> nackdelarna
- Rekommendationsstyrka 2: fördelarna > nackdelarna.
Balansen mellan nytta och skada bygger på ett antal faktorer:
- Effektmåttets kliniska betydelse. Kliniskt viktiga effektmått (överlevnad, hälsorelaterad livskvalitet) ger en högre rekommendationsgrad; surrogatmått (förändrade laboratorievärden) ger en lägre rekommendationsgrad.
- Den grundläggande risken, det vill säga naturalförloppet av sjukdomen. Om den grundläggande prognosen är allvarlig så ger det en högre rekommendationsgrad.
- Den potentiella behandlingseffekten. En stor behandlingseffekt ger en högre rekommendationsgrad.
- Biverknings- eller komplikationsrisken. Om dessa risker är stora eller potentiellt allvarliga så minskar rekommendationsgraden.
- Kostnaderna. Stora kostnader sänker rekommendationsgraden.
I vågskålen för kliniska beslut finns positiva effekter som minskad sjuklighet, längre liv, bättre livskvalitet med mera. I den andra vågskålen ligger negativa effekter såsom komplikationsrisk, obehag, upplevd smärta, uteblivna positiva effekter, biverkningar, höga kostnader etc. Denna balans avspeglar sig i rekommendationens styrka. När en stark rekommendation föreligger är bedömningen att följsamhet till den aktuella åtgärden ger potentiellt mycket stora fördelar för patienten. Vid en svag rekommendation överstiger också fördelarna de identifierade nackdelarna men i mindre utsträckning eller med större osäkerhet än vid en stark rekommendation. Innebörden av en stark rekommendation är att de flesta patienter i samma situation skulle få klart mer nytta än skada av detta alternativ och att vårdgivare rekommenderar åtgärden för de flesta patienter [29]. En rekommendation kan också gälla något som inte bör göras, särskilt när åtgärder som tidigare använts inte längre bör användas på grund av nytillkommen evidens. Den tidigare rekommendationen att ge östrogensubstitution till postmenopausala kvinnor är ett sådant exempel [32].
Om evidensgrad och rekommendationsstyrka kombineras i en tabell kan man få en uppfattning om i vilken utsträckning en viss behandling/åtgärd är lämplig (Tabell 1). Tabellen ger en fingervisning om bästa praxis. En stark rekommendation tillsammans med en hög evidensgrad (A1) innebär att de flesta patienter sannolikt bör komma i fråga för den aktuella åtgärden/behandlingen. De flesta interventioner inom medicinen bygger på medelhög evidensgrad. Om det föreligger en medelhög evidensgrad och en stark rekommendation (B1) så bör de flesta patienter komma i fråga för en sådan behandling, även om evidensen kunde vara starkare. Det råder, med andra ord, en något större osäkerhet kring den förväntade nyttan av åtgärden än om evidensen klassats som nivå A. För åtgärder klassade som C1 gäller att de flesta patienter bör komma i fråga för en sådan åtgärd även om evidensunderlaget är begränsat. Sannolikt finns i detta fall en omfattande klinisk erfarenhet av den aktuella interventionen där biverkningarna/komplikationsriskerna och kostnaderna är små i relation till den förväntade nyttan.
En stark evidens är i de flesta fall kopplad till en stark rekommendation, men inte sällan kan en diskrepans föreligga (stark evidens – svag rekommendation eller svag evidens – stark rekommendation) [33]. Nätverket ERAS Society är ett bra exempel på hur man tagit fram bästa praxis för ett stort antal åtgärder och processer inom kirurgi och anestesi (www.erassociety.org).
Redovisa evidensgrad och rekommendationsstyrka
För många diagnoser, men långt ifrån alla, finns detaljerade svenska riktlinjer framtagna. I alltför få vårdprogram/riktlinjer redovisas emellertid det vetenskapliga underlaget. I dessa fall kan man inte bedöma vilka delar som baseras på vetenskaplig evidens och vad som baseras på konsensus eller åsikter/bedömningar av olika åtgärders värde för patienterna.
Ett annat problem är att det vetenskapliga underlaget och rekommendationerna redovisas på olika sätt i olika svenska riktlinjer. Socialstyrelsen använder 12 (!) olika nivåer (rekommendation 1–10, icke-göra samt FoU). I nationella vårdprogram används olika system för att beskriva evidensens kvalitet (till exempel ++++ → +; hög → saknas; 1a → 4; A → C; I → III). Olika system för att ange rekommendationsstyrkan förekommer också (rekommendation = evidens; A → C, A → D eller A → E; Socialstyrelsens 12 nivåer; använd → använd inte). Dessa olika klassifikationssystem förvirrar och försvårar den kliniska användningen av vårdprogrammen liksom lärande och jämförelser mellan olika diagnoser.
När svenska behandlingsriktlinjer saknas kan man använda många av de utmärkta utländska som finns framtagna, till exempel i Storbritannien (NICE), USA (sökbara via National Guideline Clearinghouse) eller Australien (National Health and Medical Research Council), men dessa måste anpassas utifrån skillnader i lokala förhållanden innan de kan användas hos oss.
Förbättrad vårdkvalitet och lägre kostnader
Centers for Medicare and Medicaid Services (CMS) i USA efterfrågar i allt större utsträckning evidens för att de åtgärder man ska ersätta är ändamålsenliga, och detta har ökat följsamheten till aktuell evidens. Det har också fört med sig att ersättningar för vård som saknar eller har låg evidens har minskat [34]. Intressant är också att CMS ersätter vård som ges inom ramen för vetenskapliga studier där avsikten är att skapa ny evidens som senare kan användas som grund för framtida ersättningsunderlag. Således ersätter CMS såväl evidensbaserad vård som vård med syfte att ta fram ny evidens. Det vore angeläget att utveckla en liknande modell anpassad för svenska förhållanden för att stärka klinisk forskning och påskynda utvecklingen av bättre hälsa och vård.
En aktuell diskussion, såväl här i landet som utomlands, rör hur kvaliteten i vården kan förbättras, till exempel inom ramen för värdebaserad vård. En värdeskapande vård måste självklart bygga på bästa praxis. Det är svårt att tänka sig ett fullgott värde för patienterna, annat än i undantagsfall, med åtgärder som inte bygger på bästa praxis. Författarna till denna artikel har erfarenhet av ett program för kvalitetsförbättring (Ledarskap för värdebaserad vård) som bygger på en strukturerad process i 8 steg [35]. Ett av de mest tidskrävande och svåra stegen i detta program var att ta fram, definiera och tillämpa bästa praxis, vilket visar att medarbetare inom vården behöver stöd på detta område. Vidare måste tid och andra resurser avsättas för förbättringsarbetet. Här finns en stor men ofrånkomlig utmaning.
Även om värdebaserad vård syftar till att ge (och ersätta) vård som skapar bästa möjliga utfall för patienterna räcker det inte att mäta resultat som är viktiga för patienter. Dels är det ofta svårt att avgöra hur vissa resultat relaterar till vårdens insatser för en enskild individ med dennes samsjuklighet och följsamhet, dels kan det också ta mycket lång tid att identifiera viktiga utfall (till exempel cancerfri överlevnad vid många cancerformer eller värdet av god hypertonibehandling). Därför behöver värdebaserad vård också bygga på relevanta processmått som har stöd i bästa praxis (med möjlighet att notera skäl för avsteg från den). Processmått utgör en viktig grund för lärande, ledning och förbättring.
Sammanfattningsvis finns det många exempel på hur en förbättrad följsamhet till bästa praxis leder till en förbättrad vårdkvalitet och i många fall också till lägre kostnader [13, 14, 36]. För att kunna uppnå detta behöver sjukvården i större utsträckning än i dag använda de strategier som finns utarbetade och avsätta resurser för att ta fram, sprida, införa, mäta och analysera bästa praxis.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.