Aortastenos är den vanligaste klaffsjukdomen, och patientgruppen växer med en åldrande befolkning.
Förekomst av symtom utgör indikation för intervention då överlevnaden annars understiger 50 procent efter två år.
Intervention sker genom aortaklaffbyte med öppen eller kateterburen kirurgi.
Intervention medför i regel symtomlindring, förbättrad livskvalitet samt ökad överlevnad.
Äldre sköra patienter samt de med uttalad aortastenos och låg flödesgradient kräver särskilda överväganden.
Aortastenos är den vanligaste klaffsjukdomen, och förekomsten ökar i och med en större andel äldre i befolkningen.Patienter med symtomgivande aortastenos besväras framför allt av dyspné, angina, yrsel och svimning till följd av förträngningen av utflödet i vänster kammare samt diastolisk dysfunktion (Figur 1). Vid symtomgivande aortastenos dör hälften inom två år, och operativ behandling är det enda som förbättrar prognosen [1]. Traditionellt görs implantation av mekanisk eller biologisk klaff via sternotomi, men kateterburen intervention (TAVI, transcatheter aortic valve implantation) har blivit vanligare.
European Society of Cardiology publicerade i augusti 2017 nya riktlinjer för handläggning av klaffvitier, vilka ersätter de fem år gamla riktlinjerna [2].
Epidemiologi
Prevalensen av aortastenos ökar med åldern och är cirka 12 procent i gruppen 75 år och äldre. Därav utgörs 3 procent av tät aortastenos, men förekomsten stiger till 6 procent hos 85 år och äldre. Den åldrande befolkningen förväntas medföra en fördubbling av antalet patienter med aortastenos inom de kommande 50 åren [3-5].
Den dominerande orsaken till aortastenos är degenerativ klaffsjukdom. Patogenesen bakom degenerativ klaffsjukdom är inte fullständigt kartlagd, men bikuspid klaff, hypertoni och dyslipidemi utgör riskfaktorer [6]. Reumatisk klaffsjukdom är sällsynt i industrialiserade länder men det finns en överrepresentation bland yngre samt bland kvinnor [7]. Prevalensen av aortastenos är dock något högre hos män i respektive åldersstrata [8].
Utredning
Symtom som dyspné, angina, yrsel samt konditionsnedsättning föranleder ofta ekokardiografi och därmed upptäckt av aortastenos. Undersökningen kan också vara en del i utredning av synkope, arytmi eller nyupptäckt blåsljud. Det karakteristiska blåsljudet vid aortastenos är lågfrekvent systoliskt eller pansystoliskt, med punctum maximum parasternalt till höger och ibland med utstrålning över karotiderna. Vid tät stenos kan blåsljudet dock försvagas och andra hjärttonen falla bort. En svag och långsamt stigande karotispuls, pulsus parvus et tardus, förekommer ibland men kan vara svår att palpera vid förkalkade kärl [9].
Progressen av aortastenos är ofta långsam, och det är vanligt att patienten successivt anpassat sin fysiska funktionsnivå. Det är därför angeläget med en noggrann anamnes kring symtombörda. Att utvärdera samsjuklighet är viktigt, särskilt i de fall då intervention övervägs. Det gäller såväl andra kardiella tillstånd som samtidig kranskärlssjukdom och andra klaffvitier samt kronisk lungsjukdom, njursjukdom och diabetes.
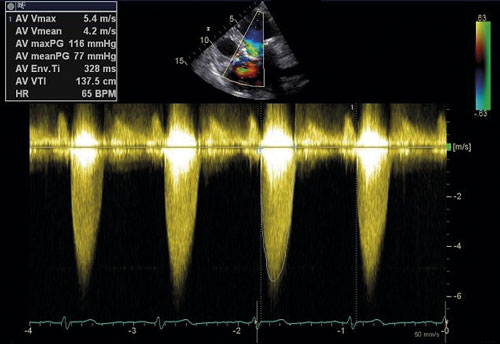
Ekokardiografi utgör en hörnsten i utredning av aortastenos (Figur 2, 3). Med kontinuerlig doppler kan tryckgradient samt medel- och maximal flödeshastighet beräknas, vilka tillsammans med uppmätt klaffarea ligger till grund för stadieindelning och prognos [10]. Utöver att visualisera klaffens grad av förkalkning ger undersökningen möjlighet att värdera övriga klaffars funktion, vänsterkammarens morfologi och funktion inklusive bestämning av ejektionsfraktion samt lungartärtryck. Transesofageal ekokardiografi kan i enstaka fall behövas för att ytterligare kartlägga anatomiska förhållanden inför exempelvis kateterburen intervention och för bättre bedömning vid samtidigt mitralisvitium [11]. Hjärtkateterisering används numera mycket sällan i diagnostiken och enbart när övriga metoder visat sig vara otillräckliga.
Natriuretiska peptider kan ge vägledning vid bedömning av lämplig tidpunkt för en eventuell intervention hos asymtomatiska patienter. Förhöjda nivåer av natriuretisk peptid av B-typ (BNP) och dess hormonellt inaktiva N-terminala del (NT-proBNP) är kopplade till ökad mortalitet och sämre postoperativt utfall, även hos patienter utan symtom [12, 13]. Arbetsprov rekommenderas hos asymtomatiska individer med uttalad aortastenos för att demaskera eventuella symtom och därmed som del i beslutsunderlag inför intervention [14].
Magnetkameraundersökning av hjärtat kan inför en eventuell intervention ge morfologisk information om kärlanatomi och visualisera grad av myokardfibros, vilket har prognostisk betydelse vid uttalad aortastenos [15]. EKG-synkroniserad datortomografi av hela aorta ned till femoralartärerna kan användas för utvärdering av lämplighet för kateterburen intervention samt för bedömning av grad av förkalkning och vidd av aorta ascendens.
Gradering
Stadieindelning av aortastenos baseras på klaffytans area, maximal flödeshastighet över klaffen och skillnaden i medeltryck mellan vänster kammare och aorta ascendens (medelgradient). Uttalad aortastenos är förenlig med en klaffarea ≤ 1,0 cm2, flödeshastighet ≥ 4 m/s och medelgradient ≥ 40 mm Hg vid normal ejektionsfraktion. Gradienterna kan påverkas av systemiskt blodtryck som bör noteras.
Det finns en särskild grupp av patienter där klaffytans area understiger 1 cm2 som vid uttalad stenos, men där medelgradienten är låg på grund av liten slagvolym, så kallad låggradient aortastenos. Detta kan bero på nedsatt vänsterkammarfunktion eller en liten men hypertrofisk vänsterkammare, vilket ofta ses hos äldre patienter med hypertoni. Vid nedsatt vänsterkammarfunktion kan ekokardiografin behöva kompletteras med dobutaminprovokation, där en oförändrad klaffarea med en stigande medelgradient till ≥ 40 mm Hg talar för en äkta stenosering [2]. Multisnitts-DT (MSCT) kan också användas för att värdera förkalkningsgraden och indexering av klaffarea i relation till kroppsytan. Gruppen med låg ejektionsfraktion och medelgradient är särskilt komplicerad, då den både har sämre prognos vid konservativ behandling och hög mortalitet vid intervention. Ökning av slagvolymen med över 20 procent vid dobutaminprovokation (så kallad flödesreserv) har visat sig vara en prognostisk faktor för gynnsamt postoperativt utfall [16].
Uppföljning
Vid uttalad aortastenos utan symtom rekommenderas uppföljningar halvårsvis eller oftare. Patienterna bör vara observanta på tillkomst av symtom och följas avseende BNP för upptäckt av försämrad vänsterkammarfunktion. Arbetsprov kan utföras vid tveksamhet om relevanta symtom.
För patienter med lindrig till måttlig aortastenos räcker uppföljning med ekokardiografi årligen. Uppföljning vartannat till vart tredje år kan räcka för yngre patienter med lindrig stenosering och utan signifikanta förkalkningar.
Behandling
I val av handläggning där intervention kan vara aktuell rekommenderas multidisciplinär kompetens inom kardiologi, toraxkirurgi, radiologi och anestesi samt god kommunikation med remittent inom exempelvis primärvård eller geriatrik.
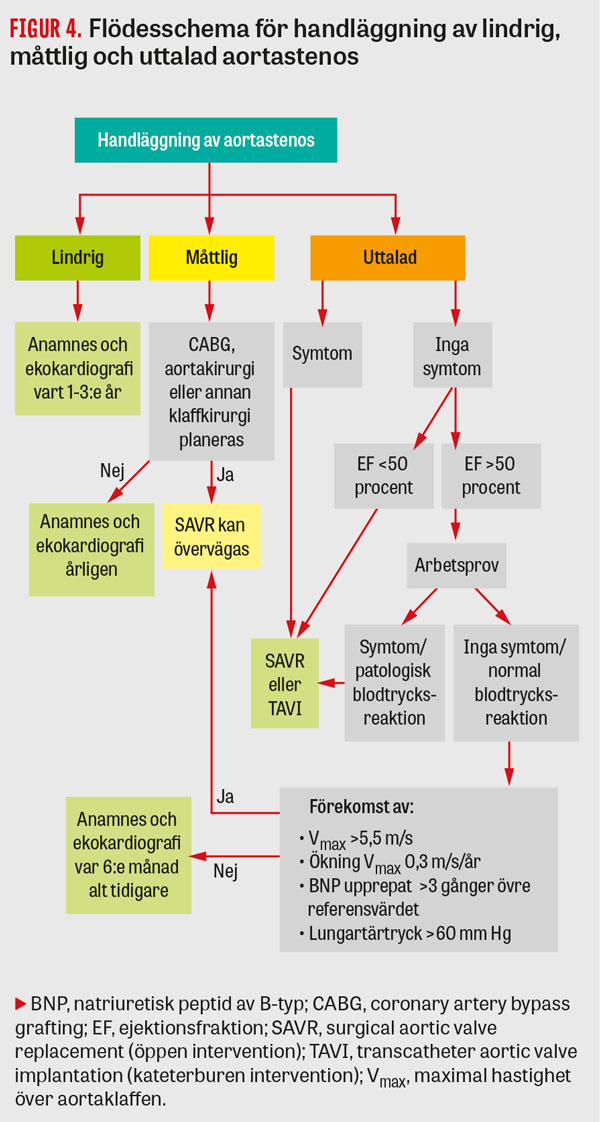
Hänsyn bör tas till stenosens allvarlighetsgrad och utveckling över tid, liksom värdering av symtom kopplade till aortastenosen (Figur 4). Dessa sammanvägda faktorer bör ställas i relation till förväntad överlevnadstid och potentiella risker vid olika ingrepp. Lokala förutsättningar och remissvägar kan också ha betydelse för valet av behandlingsmetod, liksom naturligtvis patientens eget önskemål. I riktlinjer framhålls att toraxkirurgisk kompetens bör finnas även vid enheter som endast utför endovaskulära ingrepp [2].
Farmakologisk behandling. I dagsläget finns ingen farmakologisk behandling som tycks påverka prognosen. Samtidig systolisk hjärtsvikt och hypertoni bör behandlas enligt gängse rekommendationer, med risken för blodtrycksfall i beaktande [17]. Bibehållande av sinusrytm bör eftersträvas och tillkomst av högfrekvent förmaksarytmi brukar kräva inneliggande frekvensreglerande behandling eller konvertering. Lipidsänkande behandling har inte heller visats kunna påverka naturalförloppet [18].
Indikationer för intervention. Symtomatiska patienter med uttalad aortastenos och hög medelgradient ska enligt riktlinjerna erbjudas åtgärd (rekommendationsgrad I, evidens B). Rekommendationen kvarstår oberoende av vänsterkammarfunktion, då prognosen utan intervention är mycket dålig. Tvåårsöverlevnaden har visat sig vara omkring 50 procent efter debut av symtom [1]. Intervention rekommenderas inte vid allvarlig samsjuklighet och/eller förväntad återstående livslängd under ett år samt om det inte förväntas förbättra livskvaliteten (rekommendationsgrad III, evidens C).
Gruppen med låg medelgradient kräver ytterligare eftertänksamhet. Vid samtidig nedsatt ejektionsfraktion påverkar bakomliggande orsak till denna det postoperativa resultatet. Om begränsningen utgörs av ärromvandlat myokard är postoperativ förbättring avseende vänsterkammarfunktion tveksam. Detta avspeglas i frånvaro av signifikant ökning av slagvolymen vid ekokardiografi med dobutamin. Dessa patienter har även visat sig ha en högre perioperativ mortalitet, men det finns också studier som visat en lägre femårsmortalitet efter operation jämfört med enbart konservativ behandling [16, 19]. European Society of Cardiology anser därför att intervention för denna grupp bör övervägas vid symtom, särskilt vid fynd av allvarlig förkalkningsgrad vid datortomografi (rekommendationsgrad IIa, evidens C). Symtomatiska patienter som svarar med signifikant ökad slagvolym vid dobutaminprovokation bör erbjudas operation (rekommendationsgrad I, evidens C). Vid bevarad systolisk vänsterkammarfunktion kan intervention övervägas vid symtom om uttalad stenos bekräftas genom exempelvis multisnitts-DT (rekommendationsgrad IIa, evidens C).
Vid lindrig eller måttlig aortastenos rekommenderas enbart uppföljning, men om annan öppen hjärtoperation är aktuell bör samtidig åtgärd av måttlig aortastenos övervägas (rekommendationsgrad IIa, evidens C).
Oberoende av hur tät aortastenosen är finns det inte tillräckligt stöd för en generell rekommendation om tidig intervention hos asymtomatiska patienter [20]. Vid ejektionsfraktion lägre än 50 procent liksom vid symtom under arbetsprov är intervention indicerad (rekommendationsgrad I, evidens C), då dessa förefaller ha ökad risk för plötslig hjärtdöd [2, 14]. Övriga tillfällen där intervention bör övervägas är när den maximala flödeshastigheten överstiger 5,5 m/s eller ökar med åtminstone 0,3 m/s årligen, om nivåerna av BNP trefaldigt överstiger det ålderskorrigerade normalvärdet vid upprepade mätningar eller om invasivt lungartärtryck uppmäts till över 60 mm Hg utan annan förklaring (rekommendationsgrad IIa, evidens C), förutsatt att operationsrisken bedöms som låg.
Val av intervention. Numera kan ett byte av aortaklaffen antingen ske via öppen operation (SAVR, surgical aortic valve replacement) eller kateterburen intervention (TAVI, transcatheter aortic valve implantation). Det går också att enbart vidga klaffen med en ballongkateter (ballongvalvuloplastik). Då kateterburen intervention är en förhållandevis ny metod saknas fortfarande långtidsdata avseende utfall inklusive protesernas hållbarhet.
Panoramat av komplikationer ser något olika ut för de båda interventionsmetoderna. Öppen operation har visat sig vara förenad med ökad risk för allvarlig blödning, akut njursvikt och nytillkommet förmaksflimmer. Vid kateterburen intervention finns i stället en högre risk för paravalvulärt läckage, kärlrelaterade komplikationer och behov av pacemaker till följd av totalblock [21].
Endovaskulär åtgärd med kateterburen intervention förordas hos äldre från 75 år eller där operationsrisken har bedömts som ökad (Fakta 1). Metoden har visat lägre ettårsmortalitet och minskade sviktsymtom jämfört med konservativ behandling, som även inkluderade ballongvalvuloplastik [22]. De stora randomiserade studier som gjorts för att jämföra kateterburen och öppen intervention har visat både liknande utfall och fördel för kateterburen intervention [21, 23-26]. Flera olika riskskattningssystem, däribland STS score (Society of Thoracic Surgeons score) och Euroscore (European system for cardiac operative risk evaluation), har utvecklats för att förutsäga mortaliteten efter kardiologiska ingrepp hos individer med hög risk [27, 28]. European Society of Cardiology rekommenderar numera öppen operation till patienter med låga poäng på dessa två skattningsskalor liksom avsaknad av andra riskfaktorer, medan övriga rekommenderas kateterburen intervention (rekommendationsgrad I, evidens B). Ballongvalvulotomi kan övervägas som överbryggande metod hos hemodynamiskt instabila (rekommendationsgrad IIb, evidens C). Det kan också övervägas i diagnostiskt syfte hos patienter med potentiell annan orsak till symtomen och vid organpåverkan som kan vara reversibel, exempelvis prerenal njursvikt (rekommendationsgrad IIb, evidens C).
Biologiska respektive mekaniska klaffar. Vid öppen klaffoperation står valet mellan biologisk och mekanisk aortaklaff. Fördelen med mekanisk klaff är längre hållbarhet, men blödningsrisken är högre då livslång antikoagulantiabehandling krävs [29]. Därför förordas generellt biologisk klaff till patienter med hög blödningsrisk eller om följsamhet till antikoagulantia bedöms tveksam, liksom hos patienter med en förväntad överlevnadstid som understiger klaffens hållbarhetstid. Mekanisk klaff bör övervägas till patienter under 60 år där ingen kontraindikation mot livslång antikoagulantiabehandling finns.
Antikoagulantia. För närvarande rekommenderas enbart warfarin och inte direktverkande antikoagulantia (NOAK) vid mekanisk klaffprotes, efter att dabigatran visat sig ge ökad risk för såväl blödning som tromboembolism jämfört med warfarin [30]. Vid kirurgisk implantation av biologisk klaffprotes bör lågdos acetylsalicylsyra (75–100 mg per dag) övervägas de första tre månaderna (rekommendationsgrad IIa, evidens C). Warfarin kan också övervägas under samma period, men har lägre rekommendationsnivå (rekommendationsgrad IIb, evidens C). De första tre till sex månaderna efter kateterburen intervention bör dubbel trombocythämning (oftast i form av lågdos acetylsalicylsyra och klopidogrel) ges, därefter följt av livslång monoterapi med något av preparaten (rekommendationsgrad IIa, evidens C). Om blödningsrisken bedöms som hög kan monoterapi övervägas från början (rekommendationsgrad IIb, evidens C).
Samtidig kranskärlssjukdom. Koronarangiografi bör utföras inför såväl öppen som kateterburen intervention. Vid fynd av kranskärlsstenos över 70 procent bör samtidig kranskärlsoperation (CABG, coronary artery bypass grafting) utföras vid öppen klaffkirurgi (rekommendationsgrad I, evidens C). Det bör även övervägas vid stenosgrad mellan 50 och 70 procent (rekommendationsgrad IIa, evidens C). Inför kateterburen intervention bör samtidig PCI (perkutan koronarintervention) övervägas vid fynd av stenos över 70 procent i proximala segment (rekommendationsgrad IIa, evidens C).
Endokarditprofylax. Antibiotikaprofylax vid orala ingrepp hos patienter med inopererade klaffar har varit omdiskuterad. I rekommendationerna för endokardit från European Society of Cardiology år 2015 anges att antibiotikaprofylax bör övervägas till samtliga patienter med klaffproteser (rekommendationsgrad IIa, evidens C). Som preparatval anges amoxicillin eller ampicillin i engångsdos om 2 g. Vid penicillinallergi anges 600 mg klindamycin [31]. I Läkemedelsverkets behandlingsrekommendationer »Indikationer för antibiotikaprofylax i tandvården« från 2012 frångick man en generell rekommendation om antibiotikaprofylax vid odontologiska ingrepp [32]. Ett tillägg infördes dock 2015 i rekommendationerna där antibiotikaprofylax kan övervägas till patienter med hög risk enligt European Society of Cardiology [33].
Särskilda överväganden hos äldre
Vid kateterburen intervention är såväl hög ålder som samsjuklighet i form av bland annat avancerad njursjukdom, cerebrovaskulär sjukdom och lungsjukdom förknippad med en ökad mortalitet och risk för komplikationer [34, 35]. Samtidigt har metoden visat såväl mortalitetsvinst som symtomlindring hos individer med hög risk som bedömts olämpliga för operation, vilket ställer höga krav på patientselektion [22].
Gruppen äldre är heterogen, och kronologisk ålder är inte alltid samstämmig med biologisk. När ålder betraktas som riskfaktor måste den också ställas i relation till den relativa överlevnaden i matchade ålderskontroller. Samsjuklighet påverkar också prognosen, oavsett om ingrepp utförs. Inga av de riskskattningssystem som används i riktlinjer är specifikt utvecklade för kateterburen intervention eller har visat sig vara validerade för bedömning av operativ risk hos äldre [36, 37].
Även andra faktorer såsom malnutrition, kognitiv försämring, försämrad rörlighet och aktivitetsbegränsningar i dagliga livet är kopplade till ökad incidens av kardiovaskulära komplikationer och förhöjd mortalitet efter kateterburen intervention [38]. Begreppet skörhet (frailty) används för att beskriva sköra och ofta äldre patienter med små reserver, ofta dåligt nutritionsstatus och låg fysisk prestationsförmåga. Förekomst av skörhet har i olika studier varit förknippat med försämrat utfall efter både allmän kirurgi [39] och hjärtoperationer [40]. Flera senare studier har visat att skörhet är associerad med ökad mortalitet och nedsatt hälsorelaterad livskvalitet efter kateterburen intervention [41, 42]. En svaghet med begreppet är dock att det saknas en entydig definition och att studier använder olika markörer såsom låg självvald gånghastighet, lågt serumalbumin och nedsatt kognitiv förmåga.
Förändringar i riktlinjer
Jämfört med riktlinjer från 2012 har kateterburen intervention fått en mer framträdande roll i behandlingen. I nyligen publicerade riktlinjer har också större vikt lagts vid utredningen av patienter med trolig uttalad stenos men låg flödesgradient [1, 43]. Fler studier har publicerats kring värdet av ekokardiografi med dobutamin samt värdering av klaffens förkalkningsgrad med multisnitts-DT och magnetkamera i denna grupp [15, 16]. Patienter med nedsatt systolisk vänsterkammarfunktion och utan flödesreserv har också fått en starkare rekommendation om intervention, särskilt om multisnitts-DT bekräftar uttalad stenos. Upprepade förhöjda nivåer av BNP hos asymtomatiska individer har i de nya riktlinjerna också fått ökad tyngd i planering för intervention, liksom lungartärtryck överstigande 60 mm Hg utan annan förklaring. En ny rekommendation om perkutan koronarintervention inför kateterburen intervention om fynd av kranskärlsstenos över 70 procent i proximala segment har tillkommit. Nya är också rekommendationerna avseende trombocythämmare efter kateterburen intervention.
Framtidsperspektiv
Då kateterburen intervention fortfarande kan betraktas som en ny behandlingsmetod kvarstår det att studera långtidsutfall liksom lämplig tidpunkt för intervention. Det finns också behov av att precisera och eventuellt generalisera för vilka patientgrupper behandlingen kan vara till särskild nytta. Eftersom många patienter med aortastenos är sköra äldre behövs bättre riskvärderingsinstrument, såväl för överlevnad som för hälsorelaterad livskvalitet.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Faktorer som enligt European Society of Cardiology talar för kateterburen (TAVI) framför öppen (SAVR) intervention:
- STS score/EuroSCORE II ≥4 procent eller logistisk EuroSCORE I ≥10 procent
- Ålder 75 år eller mer
- Tidigare öppen hjärtkirurgi
- Förekomst av skörhet (frailty)
- Förekomst av allvarlig samsjuklighet
- Tidigare hjärtkirurgi
- Minskad rörlighet eller tillstånd som kan försvåra postoperativ rehabilitering
- Resttillstånd efter strålning av bröstkorgen
- Uttalat förkalkad aortarot eller aorta ascendens
- Uttalad skolios eller deformerad bröstkorg
- Status efter öppen kranskärlsoperation som kan försämras efter sternotomi
- Lämplig transfemoral kärlaccess
TAVI, transcatheter aortic valve implantation
SAVR, surgical aortic valve replacement
EuroSCORE, European system for cardiac operative risk evaluation
STS-score, Society of Thoracic Surgeons-score