Arytmier är vanliga och leder ibland till allvarliga symtom, sjuklighet och dödlighet, men det finns i dag flera verksamma behandlingar som fortfarande till viss del underutnyttjas.
Vi presenterar här indikationer för olika elektriska apparater (devices) som bidrar till att återställa hjärtrytmen eller identifiera olika hjärtrytmrubbningar.
Den första pacemakerimplantationen gjordes 1958 på Karolinska sjukhuset i Stockholm [1, 2], och tekniken har därefter successivt utvecklats och förfinats. Det har tillkommit avancerad invasiv teknik för att diagnostisera [3] och reducera arytmier [4] och synkronisera hjärtats kontraktioner vid hjärtsvikt [5, 6]; dessutom finns nu interna defibrillatorer för att bryta livshotande arytmier.
Årligen nyimplanteras mer än 6 000 pacemaker-
system, omkring 1 500 interna defibrillatorer och över 1 000 sviktpacemakrar i Sverige, enligt Svenska ICD- och pacemakerregistret [7, 8].
Före beslut om invasiv arytmiövervakning/-behandling bör följande frågor ofta ställas: Har patienten optimal läkemedelsbehandling eller har patienten inte tolererat sådan behandling? Har patienten symtom? Kan invasiv arytmibehandling reducera symtom och/eller förbättra prognosen?
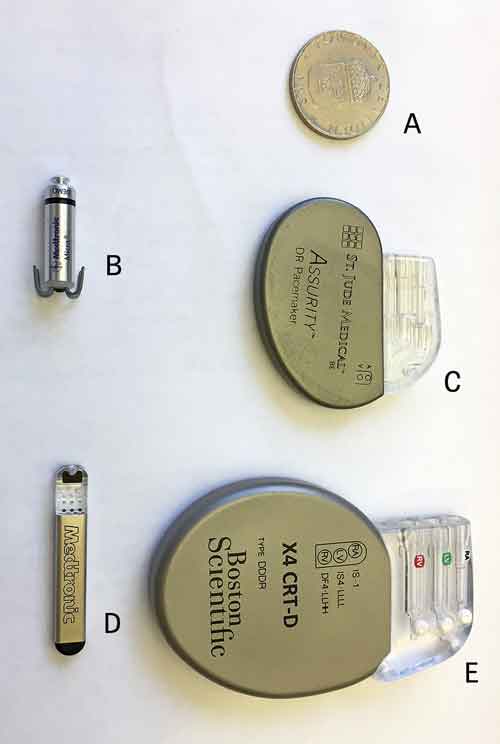
Genom denna artikel vill vi ge läkare som möter dessa patienter (som kan dyka upp överallt i sjukvården) enkla verktyg för att avgöra om det är lämpligt med remiss för invasiv arytmiövervakning/-behandling och om denna behandling kan tänkas ha positiv inverkan på symtom eller prognos. Med invasiv arytmiövervakning och -behandling menar vi i denna text olika implanterbara elektriska apparater (devices) som har till syfte att återställa hjärtrytmen eller identifiera hjärtrytmrubbningar. Några exempel på vanliga sådana apparater visas i Figur 1.
Orsaker till arytmier
Bradyarytmier beror på störningar av spontanurladdning, impulsspridning eller atrioventrikulär överledning i hjärtat [9].
Bradykardi kan orsakas av läkemedel, t ex betablockerare (även i ögondroppar) [10, 11], hjärtinfarkt, åldersrelaterad degeneration i retledningssystemet och olika ingrepp i hjärtat, t ex öppen hjärtkirurgi, transkutana klaffingrepp och etanolablation [12].
Vid många takyarytmier förekommer cirkelgång av elektriska impulser i hjärtat, s k reentry [13], eller ökad spontan urladdning, automaticitet, från ett avgränsat område i myokardiet [13]. Ärrbildning, ischemi, myokardit, inlagringssjukdom och elektrolytrubbningar predisponerar för någon av ovanstående arytmimekanismer [9].
Betydelsen av QRS-bredd vid hjärtsvikt
Förlängd QRS-duration (>120 ms) ses hos 14–47 procent av patienter med hjärtsvikt och ökar i prevalens ju mer uttalade hjärtsviktssymtom patienten har [14]. Man vet även att hjärtsviktspatienter med breddökade QRS-komplex har sämre prognos än patienter med hjärtsvikt och smala QRS-komplex [15, 16].
Före beslut om invasiv hjärtövervakning/-behandling
I detta avsnitt och i Fakta 1 redovisar vi olika åtgärder som bör vidtas före beslut om invasiv arytmiövervakning/-behandling.
Symtom, hjärtfunktion och eventuella arytmier. De vanligaste symtomen vid hjärtsvikt är andfåddhet, trötthet och bensvullnad, men arytmier är också vanligt förekommande [17]. Arytmier kan i sin tur ge många olika symtom [9], t ex trötthet, yrsel, svimning, hjärtklappning, bröstsmärta eller dyspné.
Hjärtrelaterade ospecifika symtom är relativt vanligt i befolkningen. Vid paroxysmala symtom är det alltid viktigt att försöka klarlägga om det finns en tydlig tidskorrelation mellan EKG-fynd och kliniska symtom, vilket kan göras med bl a olika former av övervakning med långtids-EKG [18].
Undersökning med ekokardiografi bör beställas med frågeställning om vänsterkammarfunktion, klaffvitier och, vid förmaksarytmier, även förmaksstorlek.
Finns ischemitecken, AV-block, förlängd QRS-duration med skänkelblock eller QT-tidsförlängning på vilo-EKG? Behövs ett arbetsprov för att utesluta ischemi?
Arytmifrekvensen [19] bör kartläggas, och man bör ta reda på om arytmin är paroxysmal eller persisterande genom långtids-EKG, upprepade EKG-kontroller eller implanterbar hjärtövervakare.
Implanterbar hjärtövervakare. En implanterbar hjärtövervakare (implantable loop recorder; ILR) [20, 21] är en liten apparat som har relativt lång batteritid (2–3 år) och som kan programmeras för att detektera bradykardi, takykardi eller förmaksflimmer hos patienter med misstänkt men inte säkerställd arytmi. Genom att apparaten kontinuerligt registrerar en »loop« av EKG-data, som raderas allteftersom ny data registreras, kan man få information om EKG-utseendet precis före och under symtom (t ex yrsel eller hjärtklappning) genom att patienten trycker på en »symtomaktiveringsknapp« på en medföljande fjärrkontroll. När patienten trycker på knappen »fryser« apparaten den EKG-loop som registrerats under de sista minuterna, och EKG:t kan sedan granskas via system för distansmonitorering eller vid besök på pacemakermottagningen.
Utöver detta registrerar apparaten automatiskt episoder av asystoli och snabba takykardier, vilket gör att det finns en sparad EKG-registrering som kan granskas i efterhand (även om patienten skulle svimma av sin arytmi).
Tum-EKG. Tum-EKG [22] är ett mellanting mellan kontinuerlig EKG-registrering under 1–7 dygn (Holter-EKG) och långtidsregistrering med implanterbar hjärtövervakare (se ovan). Genom att ge patienten utrustning för registrering av EKG-signaler via båda tummarna eller händerna vid symtom kan man ofta fånga hjärtarytmier som förekommer mer sällan, men som inte ger upphov till svimning; typexemplet är förmaksflimmer.
Medicinsk behandling vid bradyarytmi. Utred först om patientens medicinering orsakar bradykardin. Ofta innebär detta konkret att eventuell behandling med t ex betablockerare, digoxin, sinusknutehämmare och icke-kärlselektiva kalciumblockerare seponeras och hjärtfrekvensen följs. Atropin eller isoprenalin kan behöva användas för att tillfälligt höja hjärtfrekvensen i akuta situationer. Det finns däremot ingen etablerad farmakologisk långtidsbehandling vid bradykardi.
Vad innebär optimal läkemedelsbehandling vid hjärtsvikt? Optimal medicinsk behandling av hjärtsvikt betyder i regel kombinationsbehandling med betablockerare, ACE-hämmare/angiotensinreceptorblockerare och spironolakton/eplerenon i maximal tolererbar dos upp till måldoser (Tabell 1) [17]. Numera bör även sakubitril–valsartan övervägas och vid otillräcklig frekvenssänkning med betablockad även ivabradin [17].
Invasiv arytmibehandling
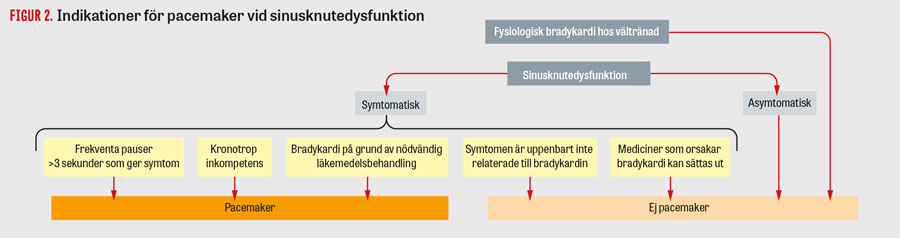
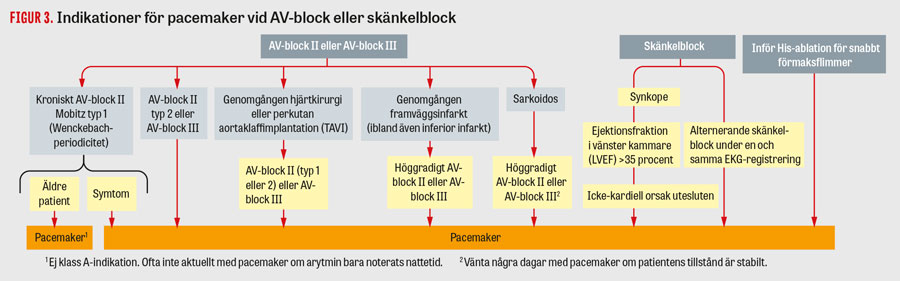
Transvenös pacemakerbehandling mot bradykardi. Pacemakrar används främst vid symtomgivande bradykardi [6, 23]. I Figur 2 och 3 presenteras de vanligaste pacemakerindikationerna [6]. Utgångspunkten är att man placerar elektroder i de hjärtrum som behöver stimuleras, beroende på indikation. Vid kroniskt förmaksflimmer är det inte indicerat att använda en förmakselektrod, utan då räcker det med en kammarelektrod för att motverka bradykardi. Vid sjuk sinusknuta utan AV-block räcker det i princip med en elektrod i höger förmak; i praktiken läggs dock i de flesta fall även en kammarelektrod i höger kammare, eftersom man sett att detta inte är behäftat med mer komplikationer och man då får ett skydd även mot senare utvecklat AV-block. Vid AV-block placeras elektroder i både höger förmak och kammare för att bibehålla AV-synkroniseringen, även om stimulering huvudsakligen sker i kammaren.
Obehandlat kroniskt AV-block III är förenat med 50 procents risk för död, oavsett symtom, inom 1 år [24]. Pacemakerbehandling leder till normaliserad återstående livslängd [25].
Så kallad kronotrop insufficiens kan uppstå dels vid primär sjuk sinusknuta, dels vid förmaksflimmer med höggradig AV-blockering. Det innebär att patienten i samband med fysisk ansträngning inte får adekvat pulsuppgång och ökning av cardiac output, vilket kan ge symtom liknande dem vid hjärtsvikt. Dagens moderna pacemakrar är utrustade med en accelerometer (även kallad sensor) som känner av om dosan (dvs överkroppen) rör sig, och de kan programmeras till att öka pulsfrekvensen i lämplig takt och till lämplig maxnivå. Det blir dock sällan lika bra som en helt fysiologisk pulsökning via en frisk sinusknuta, och vid t ex cykelsport, där överkroppen är relativt stationär, kan det vara särskilt svårt att få en bra pulsuppgång. Det finns därför även andra typer av sensorer (som mäter hjärtats kontraktilitet eller impedansförändringar i bröstkorgen) som kan vara bra för vissa patienter [26].
Kabellösa pacemakrar. Sedan några år finns kabellösa (leadless) pacemakrar [27] från ett par olika tillverkare på marknaden. Dessa implanteras via en relativt grov, styrbar introducer (24–27 French), som införs i vena femoralis och sedan manövreras till höger kammares apex eller septum. Långtidsdata är ännu begränsade, men de tidiga resultaten ser lovande ut avseende komplikationer, tillförlitlighet och batteritid. En nackdel är att man inte kan uppnå AV-synkroni vid AV-block och att pacemakern i nuläget ännu inte kan anslutas till ett biventrikulärt system eller en defibrillator.
Interna defibrillatorer. Interna defibrillatorer (implantable cardioverter-defibrillator; ICD) innehåller, förutom samma funktioner som en pacemaker, möjligheten till takykardibrytande stimulering (antitakypace; ATP) och chockbehandling vid kammartakykardi. I normalfallet använder man bara en elektrod till höger kammare, men vid stimuleringsbehov, på grund av AV-block eller sinusbradykardi (ofta medikamentellt utlöst hos dessa patienter), kompletteras med förmakselektrod. De flesta regelbundna kammartakykardier (upp till 80 procent) kan brytas med takykardibrytande stimulering, vilken innebär smärtfri snabb stimulering i kammaren och därmed inget behov av intern defibrillering [28].
Indikationer för intern defibrillator föreligger vid överlevt hjärtstopp, ventrikeltakykardi med hemodynamisk påverkan eller ventrikeltakykardi med signifikant nedsatt vänsterkammarfunktion (sekundärprevention). En patient med dokumenterad ventrikeltakykardi eller ventrikelflimmer har en återfallsrisk på 20–40 procent inom 1–2 år [29, 30]. Observera att man ska avstå från intern defibrillator om genesen till arytmin bedöms reversibel, t ex framgångsrikt behandlad ST-höjningsinfarkt, övergående elektrolytrubbning och vissa fall av akut myokardit.
Indikation för intern defibrillator (som förebyggande av plötslig död) finns dessutom hos patienter med signifikant nedsatt systolisk vänsterkammarfunktion (primärprofylaktisk indikation). Primärprofylaktisk indikation dominerar i dag [8]. I Figur 4 presenteras en algoritm för behandling. Intern defibrillator används dessutom vid en del medfödda sjukdomar i hjärtats retledningssystem som medför kraftigt ökad risk för plötslig hjärtdöd, t ex Brugadas syndrom, långt QT-syndrom och arytmogen högerkammarkardiomyopati (ARVC).
Subkutana ICD-dosor. Sedan några år finns även ett subkutant system för intern defibrillering [31] tillgängligt, s k S-ICD. Fördelen med S-ICD är att man undgår placering av elektroder transvenöst, med allt vad det innebär av risker i form av trombotisering av kärlen, infektioner, klaffpåverkan och elektroddysfunktion på grund av »skavning« när hjärtat rör sig. För unga patienter som fortfarande växer är det även en fördel att man inte nödvändigtvis behöver byta elektroden under tillväxtfasen, något som är vanligt med transvenösa elektroder hos barn. Nackdelarna är framför allt att man inte har en pacemakerfunktion på samma vis som i ett transvenöst system och att dosan är något större och otympligare för patienten; dessutom är priset i nuläget väsentligen högre än för motsvarande enkammar-ICD.
Åtgärder för patienter som fått ICD. Flertalet patienter med intern defibrillator har i dag distansuppföljning med hjälp av en internetansluten monitor i hemmet, vilket påtagligt reducerat behovet av fysiska kontroller.
Uppföljningen av patienter med intern defibrillator framgår av Fakta 2. Patienten ska söka akut om fler än en chock avgivits eller vid en avgiven chock med fortsatta symtom, såsom bröstsmärta eller dyspné. Om dosan avger larm, i form av ljudsignal eller vibration, bör patienten ringa pacemakermottagningen samma dag. Patienten uppmanas även att ringa pacemakermottagningen senast dagen efter en enstaka avgiven chock.
Inadekvata chocker, som kan upplevas mycket obehagliga, är fortfarande tämligen vanliga [32].
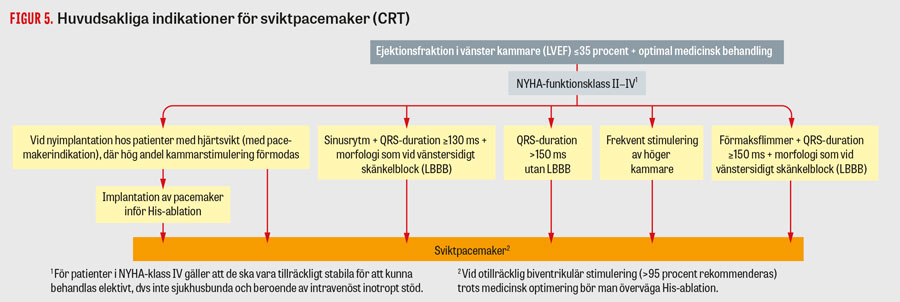
Sviktpacemaker. Sviktpacemaker (cardiac resynchronisation therapy; CRT) är en form av pacemakerbehandling med elektroder som stimulerar både höger och vänster kammare (CRT-P), och den kombineras ibland även med intern defibrillator (CRT-D) [6]. Syftet är att resynkronisera höger och vänster kammare vid hjärtsvikt med dyssynkroni, som visar sig som breddökade QRS-komplex på EKG, framför allt vänstersidigt skänkelblock [17]. Sviktpacemaker övervägs när man har försökt optimera patients hjärtsviktsbehandling (Tabell 1) och patienten har breddökade QRS-komplex på EKG (Figur 5). Patientens läkemedelsbehandling av hjärtsvikten kan erfarenhetsmässigt ofta optimeras till högre dos efter inläggning av sviktpacemaker.
Sviktpacemaker är även indicerad om patienten förväntas bli beroende av pacemakerstimulering i höger kammare, t ex vid AV-block III [17], eller om patienten fått försämrad vänsterkammarfunktion och har sviktsymtom, efter långvarig stimulering av höger kammare eller på grund av AV-block och tidigare implanterad pacemaker.
Sviktpacemakrar förbättrar överlevnad, morbiditet och vänsterkammarfunktion, medan defibrillatordelen räddar liv genom att häva livshotande kammararytmier [6]. Sviktpacemakrar har stora positiva effekter för patienter med indikation och sänker sjuklighet och dödlighet i samma storleksgrad som betablockerare och ACE-hämmare. Eftersom sviktpacemaker ges i tillägg till denna behandling blir effekten additiv.
Tyvärr är behandlingsformen otillräckligt implementerad i Sverige, vilket framgår av siffror från det nationella kvalitetsregistret RiksSvikt [33]. Omkring en fjärdedel av hjärtsviktspatienter med indikation för sviktpacemaker får i nuläget inte sådan behandling i Sverige [34].
Avancerad hjärtsvikt, svår njursvikt, svår samsjuklighet och skör patient med nedsatt allmäntillstånd och avmagring talar för att behandla med sviktpacemaker med enbart pacemakerfunktion (CRT-P) och att avstå från defibrilleringsfunktionen (CRT-D) [35].
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Åtgärder före beslut om invasiv hjärtövervakning och behandling
Är patienten optimalt medicinskt behandlad?
- Vid hjärtsvikt: Har patienten tolererat och uppnått måldoser (Tabell 1) av etablerad hjärtsviktsbehandling?
- Vid bradykardi (t ex AV-block): Har bromsande farmaka satts ut?
Har patienten symtom som kan kopplas till arytmi/hjärtsvikt?
- NYHA-klass? Yrsel? Svimning? Genomgånget hjärtstopp?
- Breddökade QRS-komplex på EKG?
- Dokumenterad ventrikeltakykardi eller ventrikelflimmer?
Behövs kompletterande utredningar?
- Ekokardiografi?
- Telemetri?
- Kontinuerlig EKG-registrering (Holter-EKG)?
- Implanterbar hjärtövervakare?
- Koronarutredning?
Kan invasiv arytmiövervakning och -behandling förbättra symtom och/eller överlevnad?
- Se indikationer Figur 2–5
Fakta 2. Uppföljning vid intern defibrillator/sviktpacemaker1
Uppföljningsfrekvens
- För patienter med sviktpacemaker varierar uppföljningsfrekvensen mellan var 3:e och var 18:e månad, utan distansuppföljning. Med distansuppföljning finns det centrum som följer upp på mottagning endast vid behov efter 2-månaderskontrollen och fram till dosbyte.
- För patienter med intern defibrillator är uppföljningsfrekvensen var 3:e till var 6:e månad, utan distansuppföljning; med distansuppföljning upp till var 24:e månad (i Lund) men enligt riktlinjer maximalt var 6:e månad.
Kontroller
- Integritet av det elektriska systemet (impedans, tröskel, avkänning).
- Förekomst av arytmier.
- Andel stimulering.
- I förekommande fall görs hjärtsviktsrelaterad diagnostik (toraximpedans, fysisk aktivitet, autonom balans).
- För patienter med sviktpacemaker kontrolleras även att inställningarna avseende atrioventrikulär och interventrikulär ledningstid är optimala.
1 Uppföljningsfrekvensen skiljer sig något mellan olika centrum i Sverige.