Endoskopisk submukosadissektion möjliggör en bloc-resektion av tidig gastrointestinal neoplasi som har låg risk för malignitet.
Endoskopisk submukosadissektion är en etablerad teknik för behandling av tidig neoplasi i ventrikel och tidig skivepitelneoplasi i matstrupen men har blandade resultat vid behandling av neoplasi vid Barretts esofagus.
Hittills har få rapporter gällande endoskopisk submukosadissektion i matstrupen publicerats i västvärlden och ingen från Skandinavien.
Vår studie visar att endoskopisk submukosadissektion är en säker och effektiv metod för behandling av tidig neoplasi i matstrupen.
Endoskopisk resektion har etablerats som en effektiv, minimalinvasiv behandling av tidig gastrointestinal neoplasi. Dessa lesioner är begränsade till de ytliga skikten av gastrointestinalkanalens vägg och innebär låg risk för spridning av neoplasin till lymfkörtlar. Endoskopisk mukosaresektion är en relativt enkel resektionsteknik där en slynga används. För små lesioner är en bloc-resektion möjlig med endoskopisk mukosaresektion, men lesioner större än 2 cm kan endast resekeras i flera fragment. En sådan bit för bit-resektion är förknippad med lokalt återkommande sjukdom i upp till 30 procent av fallen [1], och den histopatologiska bedömningen av preparatet kan inte bli lika säker och komplett som vid en bloc-resektion [2]. En ny endoskopisk resektionsteknik, endoskopisk submukosadissektion, som möjliggör en bloc-resektion av förändringar i gastrointestinalkanalen utvecklades för att lösa detta problem. I stället för en slynga används en särskild elektrokirurgisk kniv för stegvis submukosal dissektion. Denna teknik har utvecklats i Japan och dess användning har spridit sig och expanderat i väst [3, 4]. Numera är endoskopisk submukosadissektion en etablerad effektiv behandlingsmodalitet för endoskopisk resektion av premaligna och tidiga maligna lesioner i matstrupe, magsäck, tjocktarm och ändtarm [5]. Jämfört med endoskopisk mukosaresektion är endoskopisk submukosadissektion förenad med högre andel en bloc-resektioner och radikalt avlägsnade förändringar med en lägre frekvens av lokala återfall [5]. Eftersom hela förändringen tas bort i ett stycke ges bästa möjliga förutsättningar för patologen att fastställa korrekt lokalt invasionsdjup av tumören (T-stadium). Hittills har få rapporter gällande endoskopisk submukosadissektion i matstrupen publicerats i västvärlden och ingen från Skandinavien.
Syftet med denna artikel är att för första gången från Skandinavien beskriva implementering och resultat av endoskopisk submukosadissektion som behandling av neoplasi i matstrupen, inklusive tidig neoplasi i skivepitel och Barretts esofagus.
Endoskopisk bedömning
Tidig skivepitelneoplasi i matstrupen
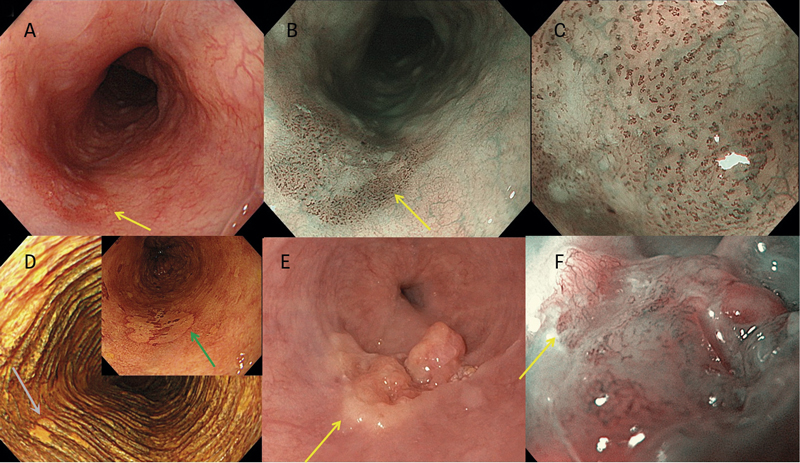
Högupplöst endoskopi. Tidig skivepitelneoplasi kan vid en noggrann undersökning ses som ett litet rödaktigt och oregelbundet slemhinnemönster eller subtila platta lesioner, men dessa förändringar kan vara svåra att upptäcka med konventionell endoskopi. Med hjälp av endoskop med hög upplösning och erfarna ögon upptäcks de flesta lesioner vid endoskopi [6]. Morfologin för alla synliga lesioner bör beskrivas med hjälp av Paris-klassifikationen [7]. Dessutom bör lesionens avstånd till tandraden samt läge i cirkumferensen (klockslag) registreras.
Kromoendoskopi. För att upptäcka tidig skivepitelneoplasi utförs vanligen en särskild sorts kromoendoskopi, »narrow band imaging«. Denna teknik utnyttjar färgfilter som förstärker slemhinneytans och kärlstrukturernas mönster. Tidig neoplasi i slemhinnan kan identifieras som bruna områden med skarpa intraepiteliala papillära kapillärslyngor. Vid Lugolfärgning framträder ytlig neoplasi (m1/m2, se Figur 1) som lugol-avstötande lesion med sin typiska rosa färg och det så kallade tatami-no-me-tecknet, som talar mot inväxt i submukosan. (Tecknet har fått sitt namn efter den traditionella japanska mattan tatami.) Ju mer invasiv lesionen blir, desto mer oregelbundet blir mönstret (Figur 2).
Tidig neoplasi vid Barretts esofagus
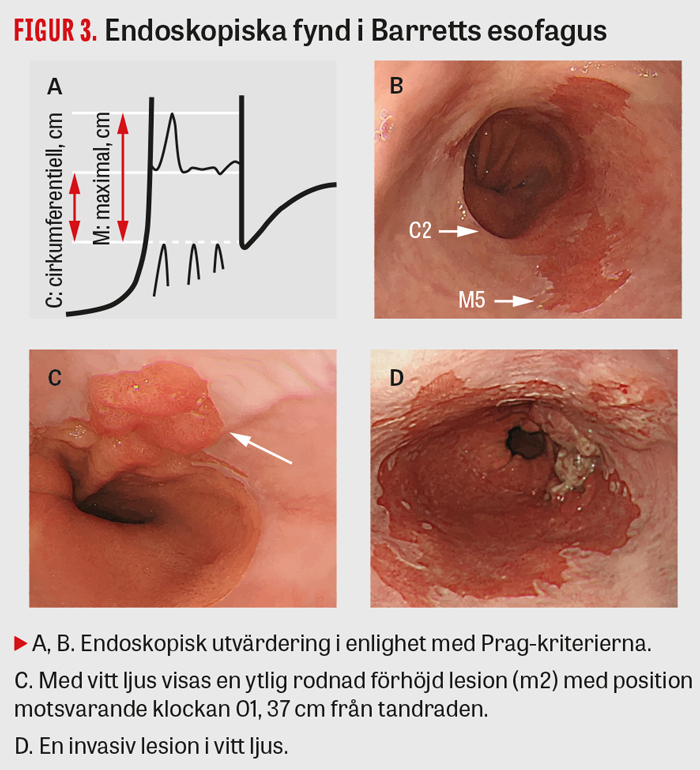
Högupplöst endoskopi. Vid neoplastisk Barretts esofagus bör endoskopisk utvärdering och rapportering standardiseras i enlighet med Prag-kriterierna (cirkumferent utbredning [C], maximal utbredning [M] av endoskopiskt synlig cylinderepitelslemhinna, se Figur 3a [8]). Synliga lesioner ska karakteriseras och beskrivas enligt Paris-klassifikationen [7] med angivande av avstånd till tandraden och läge i cirkumferensen (Figur 3).
Kromoendoskopi. Olika former av kromoendoskopi finns i bruk för att skilja mellan intestinal metaplasi, höggradig dysplasi eller adenokarcinom, där metylenblått, ättiksyra, kristallviolett eller narrow band imaging utnyttjas. Alla synliga lesioner vid Barretts esofagus bör beskrivas och biopseras. Biopsier ska även tas utan lesioner i varje kvadrant, varannan cm, enligt Seattle-protokollet [9].
Indikationer för endoskopisk behandling
Tumörens T-stadium är direkt relaterat till risken för lymfkörtelmetastasering, som i sin tur är den viktigaste faktorn gällande prognos och vidarebehandling vid tidig neoplasi [10].
Vid tidig skivepitelneoplasi är risken för lymfkörtelmetastaser 0 procent för intraepiteliala lesioner (m1) samt lesioner som invaderar lamina propria (m2). Denna risk ökar till 8–18 procent för lesioner som invaderar lamina muscularis mucosae (m3), 11–53 procent för lesioner som invaderar submukosaskiktet till 200 μm eller mindre (sm1) och 30–54 procent för djupare lesioner (sm2) [5] (Figur 1). Enligt internationella riktlinjer [5] [11] utgör förekomsten av m1–2-neoplasi en absolut indikation för endoskopisk behandling, eftersom kurativ resektion uppnås i nästan alla dessa fall. För m3–sm1-neoplasi och lesioner som påverkar ≥ 3/4 av den luminala omkretsen är indikationen för endoskopisk resektion »relativ« på grund av låg, men inte försumbar, risk för lymfkörtelmetastasering. I sm2 eller djupare lesioner anses endoskopisk behandling inte vara botande och rekommenderas inte.
Vid neoplastisk Barretts esofagus rekommenderas endoskopisk behandling när lesionerna begränsas till slemhinnan eller ytlig submukosa (≤ 500 μm, sm1) och är väl eller måttligt differentierade utan lymfatisk eller vaskulär invasion [5, 12]. Dessa fall har en låg risk för lymfkörtelmetastasering (1,4 procent), och endoskopisk behandling anses vara botande.
Komplikationer
Komplikationer efter endoskopisk submukosadissektion i matstrupen inkluderar blödning, perforation och striktur, som kan förekomma i 0–5 procent, 0–10 procent respektive 0–17 procent av fallen [13]. Blödning under eller efter ingreppet behandlas vanligtvis endoskopiskt. Perforation under endoskopisk submukosadissektion kan oftast behandlas framgångsrikt med endoskopisk förslutning med endoskopiska clips eller stent. Dock kan fördröjd perforation efter endoskopisk submukosadissektion, vilket är sällsynt, kräva kirurgisk behandling. De vanligaste behandlingsalternativen vid esofagusstriktur är endoskopisk ballongvidgning, orala eller lokala steroider och stent [14].
Genomförande i Sverige
En förutsättning för att utföra säker endoskopisk submukosadissektion är stor erfarenhet av diagnostisk och terapeutisk endoskopi. Lämpligt urval av patienter är också avgörande för ett gott resultat. Det är nödvändigt att behärska de specifika redskapen och de tekniker som används, till exempel högupplösande endoskopi, hemostas, applikation av clips och vävnadshantering. Internationella riktlinjer [5, 11] rekommenderar särskilda riktade kurser, träning i djurmodell samt upprättad kompetens inom endoskopisk submukosadissektion i magsäck och ändtarm innan man börjar använda metoden i matstrupen.
Karolinska universitetssjukhuset är referenscentrum för diagnos och handläggning av neoplasi i matstrupen. Sedan 2011 behandlas på Karolinska universitetssjukhuset tidig skivepitelneoplasi och Barretts esofagus i första hand med endoskopisk submukosadissektion, efter implementering av tekniken enligt ovanstående rekommendationer.
Metod på Karolinska
Patienter som remitteras till Karolinska universitetssjukhuset för neoplasi eller cancer i matstrupen vårdas i ett sammansatt patientflöde – en enda vårdkedja. Först diagnostiseras och klassificeras tidig skivepitelneoplasi och Barretts esofagus enligt ovanstående riktlinjer. Beslut om endoskopisk submukosadissektion tas alltid först efter rekommendation från multidisciplinär terapikonferens och med patientens informerade samtycke. Patienten vårdas inneliggande på kirurgisk vårdavdelning i samband med ingreppet och enligt standardiserade riktlinjer. Samtliga resektioner föredras sedan på särskild multidisciplinär terapikonferens med närvarande patolog.
Teknik
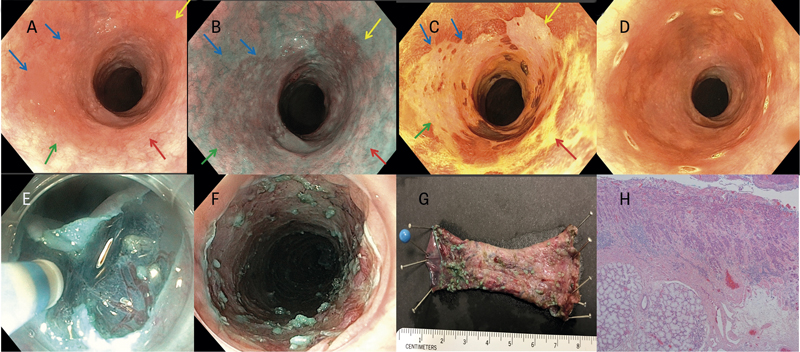
Vid vår enhet utförs endoskopisk submukosadissektion i matstrupen av specialiserade endoskopister och alltid i full intubationsnarkos. För ingreppet används en endoskopisk kniv och övre gastrointestinalt endoskop. En standardgenerator används för elektrokirurgisk ström. När tumörens utbredning är fullständigt bedömd markeras utbredningen med små brännpunkter med en kniv (Figur 4A–D). Hyaluronsyra injiceras sedan i det submukosala skiktet för att lyfta slemhinnan. En initial slemhinneincision görs med en kniv på den proximala eller distala sidan av tumören och därefter delas slemhinnan runt hela tumören (Figur 4E–F). Tumören avlägsnas sedan fullständigt genom submukosal dissektion (Figur 4G-H).
Vi presenterar här vår enhets tidiga resultat avseende effektivitet, säkerhet och utfall efter implementering av endoskopisk submukosadissektion i matstrupe. Det primära utfallsmåttet var graden av en bloc-resektion. Sekundära utfallsmått var graden av resektion, procedurens tidsåtgång och procedurrelaterade biverkningar. En bloc-resektion definieras som excision av förändringen i ett enda stycke. Kurativ resektion definieras som R0-resektion (fullständig)av en lågrisktumör [5, 11]. För att utvärdera vår inlärningskurva skapade vi ett kronologiskt index för tid (min)/resekerad storlek (mm) för alla ingrepp. Därutöver utvärderades andelen en bloc-, R0- och kurativa resektioner.
Resultat
Totalt utfördes endoskopisk submukosadissektion på 63 neoplasier i matstrupen hos 53 patienter mellan juni 2011 och juni 2017 på Karolinska universitetssjukhuset. Patienterna hade en medelålder av 67 år (46–84), 16 (30 procent) var kvinnor och 37 (70 procent) män.
Den vanligaste lokalisationen för endoskopisk submukosadissektion var gastroesofageala övergången/ distala esofagus (45/63; 71,4 procent) jämfört med mellersta eller övre delen av matstrupen (18/63; 28,6 procent). De flesta lesionerna bedömdes enligt Paris-klassificeringen som typ 0-IIa (32/63; 50,8 procent), 0-IIb (17/63; 27,0 procent) eller 0-I (11/63; 17,4 procent). Av 63 fall var 54 Barretts esofagus (5 med låggradig dysplasi och 49 med höggradig dysplasi/adenokarcinom). Nio lesioner var tidig skivepitelneoplasi. Den genomsnittliga storleken av resektaten var 49 mm (15–150 mm).
I alla fall utom ett (62/63; 98 procent) utfördes resektionerna en bloc. R0 och kurativa resektioner erhölls i 79 procent (50/63) respektive 67 procent (42/63). Den genomsnittliga procedurtiden var 120 minuter. En fördröjd perforation (1,6 procent) inträffade och behandlades framgångsrikt endoskopiskt med stent [15]. Det uppstod 2 (3,2 procent) postoperativa blödningar som behandlades konservativt. Sex patienter (9,5 procent) utvecklade striktur i matstrupen; alla åtgärdades framgångsrikt endoskopiskt. Genomsnittlig (median) sjukhusvistelse var 3 dagar, och 30-dagarsmortalitet var 0 procent. Bakgrundsdata och utfall för endoskopisk submukosadissektion i matstrupe är sammanfattade i Tabell 1.
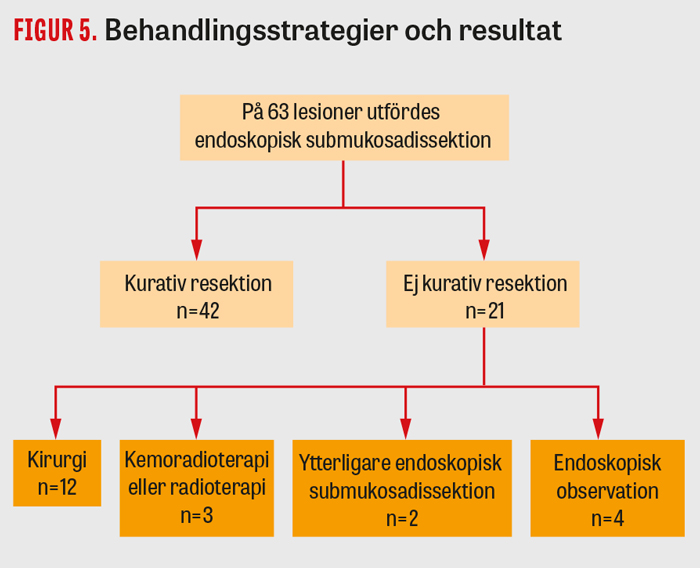
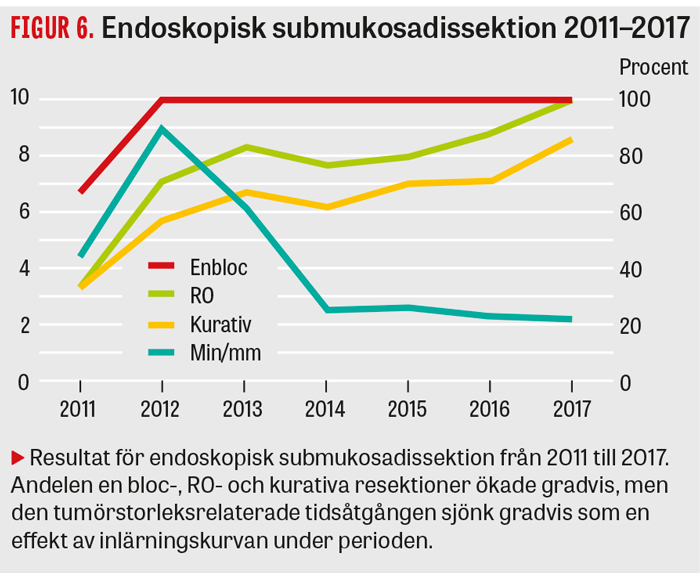
Av 42 fall med kurativ resektion (R0 med försumbar risk för lymfkörtelmetastaser) var alla recidivfria vid uppföljning (medelvärde 22 månader, intervall 1–60 månader). Av 21 patienter där endoskopisk submukosadissektion inte bedömdes som kurativ genomgick 12 patienter kirurgisk resektion av esofagus, 3 patienter behandlades med kemoradioterapi eller strålbehandling, 2 patienter genomgick ytterligare endoskopisk submukosadissektion och 4 patienter planerades för endoskopiska kontroller. Figur 5 ger en översikt över kliniska resultat och uppföljningsdata för alla 63 behandlade neoplasier. Från 2011 till 2017 ökade andelen en bloc-, R0- och kurativa resektioner gradvis, medan den tumörstorleksrelaterade tidsåtgången gradvis sjönk som en effekt av inlärningskurvan (Figur 6).
Konklusion
Endoskopisk submukosadissektion har etablerats på Karolinska universitetssjukhuset som ett värdefullt endoskopiskt terapeutiskt verktyg. Vi redovisar för första gången resultat och uppföljningsdata för genomförandet av denna teknik i Sverige. Våra resultat bekräftar att endoskopisk submukosadissektion är en effektiv och säker modalitet för behandling av neoplasi i matstrupen. Denna teknik har utvecklats inom vår enhet som ett resultat av växande erfarenhet. Implementering av metoden inom övre gastrointestinalkanalen är möjlig i västvärlden, förutsatt tillräckligt hög volym av patientfall, lämplig träning, standardisering av förfarandet och omsorgsfull selektion av patientfall.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.