Whipples sjukdom är en kronisk infektionssjukdom som orsakas av bakterien Tropheryma whipplei.
Sjukdomen drabbar primärt tunntarmen, men flera organ kan vara engagerade.
Det är svårt att misstänka Whipples sjukdom både på grund av att den är sällsynt och att den ger ospecifika och långvariga symtom.
Vanliga symtom är migrerande artralgi/artrit med eller utan feber, viktnedgång, diarré, buksmärtor, lymfadenopati, hypoalbuminemi och anemi.
Sjukdomen är progredierande med letal utgång om den inte upptäcks och behandlas i tid; därför bör man ha den i åtanke som en viktig differentialdiagnos vid långvariga ospecifika symtom, särskilt i kombination med feber.
Whipples sjukdom är en infektionssjukdom som orsakas av den grampositiva bakterien Tropheryma whipplei. Whipples sjukdom beskrevs första gången 1907 av George H Whipple, men dess infektiösa etiologi upptäcktes först 1961 med elektronmikroskopi. År 1991 användes polymeraskedjereaktion (PCR) för att klassificera bakterien till gruppen Actinomycetes [1-3].
Enligt en epidemiologisk studie av 664 patienter med Whipples sjukdom från USA drabbades i 86 procent av fallen män; 98 procent var av kaukasiskt ursprung och medelåldern vid diagnosen 49 år [4]. De flesta patienterna var bönder som yrkesexponerats för mark eller djur.
Enligt en senare tysk studie noterades att fraktionen kvinnor var högre och låg på 22 procent, medan medelåldern var 51 år vid diagnosen [5].
Bakterien har isolerats i vatten, vilket innebär att en fekal–oral smittväg förutsätts [6]. Efter kontakt med bakterien kan den smittade personen bli asymtomatisk bärare av T whipplei [7]. Förekomsten hos friska bärare kan ha överskattats i vissa studier, men enligt en studie av 620 friska individer var PCR positiv för bakterien i salivprov hos 0,6 procent och i fecesprov hos 1,5 procent [8]. Studier har visat att det ofta krävs en genetisk predisposition för att utveckla sjukdomen, en Th1-immundefekt, särskilt hos CD11b-lymfocyter som spelar en viktig roll vid aktivering av makrofager som fagocyterar och oskadliggör T whipplei.
Låg produktion av interleukin-12 i monocyter och låg serumkoncentration av interleukin-12p40 bidrar till nedsatt funktion av makrofager [9]. Det finns få studier rörande prevalens och incidens av sjukdomen, men enligt den senaste som genomfördes i Italien uppskattades prevalensen vara 3 per 1 000 000 personer [10]. De flesta rapporterade fallen kommer från Nordamerika och Europa.
Sjukdomen drabbar primärt tunntarmen men flera organ kan vara engagerade, till exempel leder, hjärna, lungor och hjärta. Sjukdomen kan leda till döden om den inte behandlas. Sjukdomen är svår att diagnostisera på grund av att den är sällsynt, ger ospecifika och långvariga symtom samt ofta har en atypisk manifestation i form av till exempel viktförlust och lymfadenopati som kan föra tankarna till exempelvis lymfom [11, 12].
Säkerställandet av diagnosen Whipples sjukdom bygger på histopatologisk undersökning av biopsimaterial och PCR-analys för 16S rRNA. Det viktigaste histopatologiska kännetecknet är fyndet av PAS (perjodsyra–Schiff)-positiva inklusioner i histiocyter i lamina propria från tunntarmsslemhinnan, främst i duodenum eller jejunum, men även från andra drabbade vävnader i kroppen [13].
Syftet med denna fallbeskrivning är att öka uppmärksamheten på en mycket ovanlig sjukdom med en kombination av symtom som liknar andra och betydligt vanligare sjukdomar.
Fallbeskrivning
Patienten är en 37-årig man av svenskt ursprung, sporadisk rökare och snusare sedan ungdomen, som konsumerar måttliga mängder alkohol, är gift och har friska barn. Han bor på landet och är yrkeschaufför men reser endast inom Sverige.
Han diagnostiserades 2015 med tyreoideahormonresistens och palindromisk reumatism. Hans reumatiska besvär började 2014 med en övergående svullnad i ringfingret men han sökte då inte vård. Under de kommande 12 månaderna tillkom episoder av feber och smärta, stelhet och i perioder även svullnader i fotleder, knäleder och armbågar. Symtomen var symmetriska och migrerande med maximalt två veckors varaktighet. Dessa besvär bedömdes av reumatolog initialt som palindromisk reumatism och han behandlades med NSAID. Under 2016 hade han en liknande episod och fick en peroral prednisolonkur i en månad utan framgång. Reumatologen ändrade diagnosen till seronegativ reumatoid artrit och han sattes in på både metotrexat och hydroxiklorokin. Under denna behandling hade han fortfarande stelhet i lederna, men svullnaden avtog.
Under 2017, nio månader efter påbörjad behandling, började han få gastrointestinala symtom i form av flatulens, icke-blodiga diarréer och kräkningar enstaka dagar. Han hade även feber till och från och lätt viktnedgång. BMI var 18,4 kg/m2 (ursprungs-BMI 19,7 kg/m2). Diarréerna blev successivt värre med lösare avföringskonsistens, mer frekvent tarmtömning och tillkomst av buksmärtor. Han sökte primärvården, där man upptäckte anemi med Hb 120 g/l (referensintervall 134–170 g/l), hemoglobin i feces (tre positiva prov), hypoalbuminemi på 21 g/l (referensintervall 35–45 g/l) och förhöjt kalprotektin i feces på 244 mg/kg (referensintervall 0–50 mg/kg). Han försämrades ytterligare med vattentunna diarréer upp till 30 gånger per dygn utan blod- eller slemtillblandning, tillkomst av trötthet och B-symtom som nattliga svettningar och febertoppar upp till 40 °C. Efter en månad genomgick han rektoskopi på vårdcentralen som inte visade några avvikelser. Då hade han gått ner ytterligare 5 kg i vikt (BMI 17 kg/m2). Han remitterades till akutmottagningen på Gävle sjukhus och lades in för utredning.
Under vårdtiden gjordes en DT av buken som visade tecken på tunntarmsinflammation högst upp på vänster sida, varför man initialt misstänkte inflammatorisk tarmsjukdom (IBD) – i första hand Crohns sjukdom. Patienten stod på folsyra 5 mg varje morgon tre gånger i veckan, metotrexat 20 mg en gång i veckan, hydroxiklorokin 200 mg varje morgon, diklofenak 50 mg (en tablett vid behov) och paracetamol 665 mg (två tabletter vid behov). Blodprov vid inläggning visade B-LPK 9,2 × 109/l, B-Hb 116 g/l av mikrocytär hypokrom karaktär, B-retikulocyter 24,6 × 109/l, B-TPK 397 × 109/l, P-CRP 19 mg/l, normalt elektrolytstatus, P-albumin 22 g/l, P-ALP 2,20 μkat/l, övrigt leverstatus utan anmärkning, P-transferrinmättnad 54,7 μmol/l, P-ferritin 119 μg/l, P-PK 1,2, P-APTT 42 sekunder och B-SR 16 mm. Fecesodlingar för Salmonella, Shigella, Yersinia och Campylobacter var negativa. Cytotoxin A och B för Clostridium difficile kunde inte påvisas. Gastroenterologkonsult rekommenderade koloskopi. Kompletterande svar på DT av buken beskrev patologiskt förstorade lymfkörtlar paraaortalt sträckande sig från övre delen av buken ned till lilla bäckenet och även ventralt i mesenteriet. På grund av fynden av lymfadenopati, viktnedgång och B-symtom ändrades arbetsdiagnosen från IBD till högmalignt lymfom. Patienten remitterades därför till onkologmottagning för vidare utredning/omhändertagande. Koloskopin planerades att genomföras polikliniskt inom kort. Patientens tillstånd försämrades dock snart efter utskrivningen från medicinkliniken med betydande trötthet, fortsatt högfrekventa och vattentunna diarréer 15–20 gånger per dygn med tillkomst av blodtillblandning. Han hade svårigheter att nutriera sig på grund av illamående och kräkningar och hade minskat ytterligare 5 kg i vikt (BMI 15,9 kg/m2).
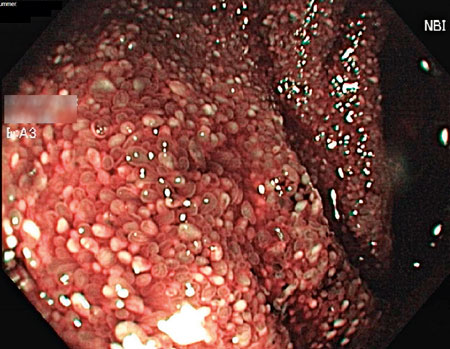
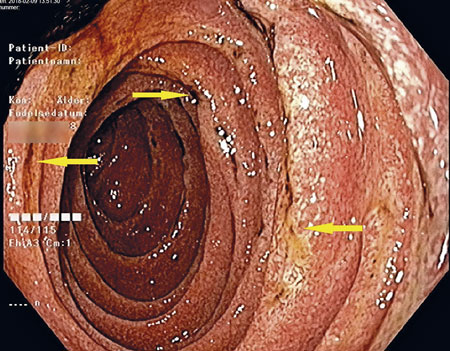
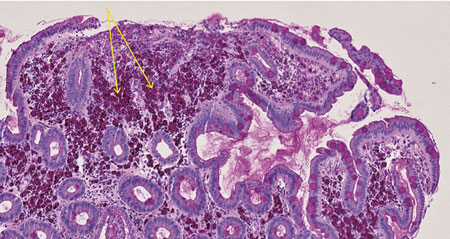
Patienten lades in direkt på onkologavdelning och erhöll tranexamsyra mot rektala blödningar, vätska intravenöst och total parenteral nutrition. Koloskopi gjordes som makroskopiskt visade tecken på relativt färsk blödning, dock utan säker blödningskälla, men ingen IBD-bild utan bara ospecifikt diffust slemhinneödem. Det noterades generellt diffust svullen slemhinna i distala ileum med rikligt med vitfärgade villi (Figur 1 och 2). Den endoskopiska bilden i distala ileum väckte misstanke om Whipples sjukdom, varför biopsi togs med den frågeställningen och PCR för 16S rRNA mot T whipplei gjordes. Biopsin visade i lamina propria lätt till måttligt lymfoplasmacellulärt PAS-positivt infiltrat med ett flertal histiocyter, således en bild förenlig med Whipples sjukdom (Figur 3). Patienten genomgick även gastroskopi som makroskopiskt visade en bild av akut duodenit med ett flertal smala fibrin- och hematinbelagda ytliga ulcerationer (Figur 4). Biopsi från duodenum visade samma bild som vid ileumbiopsin, det vill säga PAS-positiva histiocyter med diastasresistent granulerad cytoplasma, vilket är ett diagnostiskt kännetecken för Whipples sjukdom (Figur 5). PCR-analys för 16S rRNA från likvor var negativ; således kunde CNS-engagemang uteslutas. Under tiden på onkologavdelningen genomgick patienten exstirpation av en paraaortal lymfkörtel som också visade bild kompatibel med Whipples sjukdom. PCR för 16S rRNA från serum, distala ileum och duodenum var positiv för T whipplei, vilket bekräftade diagnosen. Patienten sattes in på ceftriaxon intravenöst 2 g × 1 med markant effekt redan efter 3 dygns behandling. Diarréerna minskade, patienten började nutriera sig peroralt och gick upp 3,5 kg i vikt under vårdtiden. Transtorakal ekokardiografi visade inga tecken på endokardit eller andra avvikelser. Patienten skrevs ut med ceftriaxon 2 g intravenöst dagligen i två veckor och därefter planerad övergång till peroralt sulfametoxazol–trimetoprim 160 mg/800 mg 1 × 2 i ett år.
Vid första kontrollen 3 veckor efter utskrivningen hade patienten gått upp ytterligare 3 kg i vikt (BMI 15,8 kg/m2) men var fortfarande svag, blev snabbt trött, var orkeslös och subfebril. Han hade fortfarande järnbristanemi och uttalad zink- och D-vitaminbrist som substituerades och bedömdes sekundär till malabsorption.
Sex veckor efter utskrivningen var patienten besvärsfri och hade ökat 7 kg i vikt, men var fortfarande svagt underviktig med BMI 17,6 kg/m2.
Sex månader efter diagnosen var patienten fortfarande besvärsfri, hade normala laboratorieprov och hade gått upp ytterligare 5 kg i vikt (BMI 18,9 kg/m2). Han hade redan börjat arbeta heltid.
Diskussion
Whipples sjukdom drabbar flera olika organsystem i kroppen och kännetecknas av symtom såsom ledbesvär, feber, diarré, malabsorption och viktnedgång. Detta breda spektrum av symtom och det faktum att inte alla symtom brukar vara manifesta hos alla drabbade patienter gör att sjukdomen är mycket svår att misstänka och diagnostisera. Det klassiska debutsymtomet av sjukdomen är ledbesvär, hos 80 procent av patienterna, som föregår de andra symtomen (Fakta 1). Främst drabbas stora leder (knän, handleder och anklar) i form av migrerande artralgi/artrit. Många patienter får diagnosen seronegativ reumatoid artrit i början, och enligt en fransk studie får hälften av dem immunmodulerande terapi, inklusive anti-TNF-α-behandling [14]. Anti-TNF-α-behandling kan avslöja och/eller förvärra sjukdomen, särskilt etanercept i kombination med andra sjukdomsmodifierande antireumatiska läkemedel, speciellt metotrexat och kortikosteroider [15]. Gastrointestinala symtom uppträder senare i sjukdomsförloppet med intermittenta vattentunna diarréer som kan bli blodiga, krampliknande buksmärta och viktnedgång. Feber rapporteras i 25–40 procent av fallen [16]. Hälften av patienterna har lymfadenopati i framför allt mesenteriska och mediastinala lymfkörtlar, vilket som i vårt fall lätt kan väcka misstanke om lymfom [14]. Isolerade symtom från CNS kan förekomma senare i sjukdomsförloppet, till exempel demens och andra neurologiska fynd som supranukleär oftalmoplegi, nystagmus eller myokloni. Endokardit och vitier är de vanligaste hjärtmanifestationerna av Whipples sjukdom och ses hos ungefär hälften av patienterna, ännu fler i obduktionsstudier. Framför allt drabbas aorta- och mitralisklaffen men även perikardit, myokardit och kranskärlsarterit har rapporterats [17]. Sjukdomen är svår att diagnostisera mikrobiologiskt då det kan ta månader innan framgångsrik odling av T whipplei kan göras; detta är opraktiskt och används inte i klinisk vardag. Dessutom är serologisk undersökning inte användbar i diagnostiken eftersom både patienter med Whipples sjukdom och upp till 70 procent av friska individer kan utveckla ett T whipplei-specifikt humoralt immunsvar [9].
Diagnosen Whipples sjukdom ställs därför vanligen histopatologiskt med påvisande av PAS-positiva inklusioner i histiocyter i biopsimaterial från duodenum eller jejunum, men även från annan vävnad såsom ledvätska, lymfkörtlar, cerebrospinalvätska och hjärtklaffar [13]. I vårt fall ställdes diagnosen i första hand via biopsi från distala ileum. Specifik kvantitativ PCR för T whipplei (16S rRNA) från saliv och feces anses vara första linjens icke-invasiva detektion för Whipples sjukdom med hög specificitet om båda proven är positiva men låg sensitivitet vid lokaliserad Whipples sjukdom, där i stället invasiva prov (biopsi) från olika drabbade vävnader tas [18]. I majoriteten av fallen är tunntarmen engagerad, men lesioner relaterade till Whipples sjukdom kan vara minimala, vilket kan leda till falskt negativa resultat, särskilt hos patienter som saknar gastrointestinala symtom. Därför rekommenderas upprepade biopsier vid stark misstanke om Whipples sjukdom [19].
För att kunna säkerställa diagnosen i dessa fall bör två olika metoder användas, såsom biopsi med PAS-färgning och/eller PCR för 16S rRNA, till exempel:
- både biopsi och PCR är positiva från samma prov
- både biopsi och PCR är positiva från olika prov, till exempel positiv PAS-färgning från duodenum och PCR från synovialvätska
- positiv PCR från två olika organ, till exempel duodenum och synovialvätska.
Eftersom de flesta bärare av T whipplei inte utvecklar Whipples sjukdom och med tanke på svår diagnostik är det viktigt att först utesluta vanligare sjukdomar som kan orsaka liknande symtom. Till dessa hör inflammatorisk tarmsjukdom, kronisk infektiös enterokolit, reumatiska sjukdomar, lymfom, hiv-infektion och tuberkulos.
Whipples sjukdom har en mycket dålig prognos om den inte behandlas [8]. Det är viktigt att behandla patienter med antibiotika som penetrerar blod–hjärnbarriären med tanke på att T whipplei ofta finns i cerebrospinalvätska [20]. PCR för T whipplei blir negativ snart efter påbörjad antibiotikabehandling.
Whipples sjukdom utan CNS-engagemang behandlas initialt med intravenöst ceftriaxon 2 g en gång dagligen eller intravenöst bensylpenicillin 1,2 g (2 miljoner IE) var 4:e timme i 2 veckor, följt av underhållsbehandling med peroralt trimetoprim–sulfametoxazol 160 mg/800 mg två gånger per dygn i ett år [21]. Behandlingen är densamma vid Whipples sjukdom som vid endokardit. Om det finns CNS-engagemang ges dubbel dos bensylpenicillin, det vill säga 2,4 g (4 miljoner IE) i stället för 1,2 g.
Strax före avslutandet av antibiotikabehandling rekommenderas gastroskopi med biopsi från duodenum och även PCR-test för att säkerställa den fortsatta läkningen. Patienter som är allergiska mot ceftriaxon eller penicillin kan i stället behandlas med trimetoprim–sulfametoxazol 160 mg/800 mg tre gånger om dagen plus streptomycin 1 g intramuskulärt en gång om dagen i två veckor, följt av trimetoprim–sulfametoxazol två gånger om dagen i ett år.
Patienter som är allergiska mot sulfametoxazol får i stället som underhållsbehandling doxycyklin 100 mg peroralt två gånger om dagen plus hydroxiklorokin 200 mg peroralt tre gånger om dagen i ett år [9]. Det finns 9–15 procents återfallsrisk efter avslutad antibiotikabehandling, då T whipplei kan persistera latent i kroppen i många år, främst hos patienter med CNS-engagemang [22]. Det genomsnittliga intervallet mellan diagnos och återfall är 4,2 år, men enligt rapporterade fall kan det inträffa även efter 30 år [23]. Därför rekommenderas årliga kliniska kontroller i flera år. Cefixim har visat sig vara effektivt hos patienter med återfall efter avslutad behandling med trimetoprim–sulfametoxazol [23].
Slutsatser
Vi beskriver ett fall av en extremt ovanlig sjukdom med symtom från olika organsystem där det varit svårt att ställa rätt diagnos initialt. Symtomen hos en mindre andel patienter med Whipples sjukdom manifesteras bara i ett organsystem, till exempel genom endokardit eller som i vårt fall artrit/artralgi, initialt i några år, vilket gör sjukdomen ännu svårare att misstänka. Vår patient bedömdes av flera specialister och fick olika diagnoser, såsom seronegativ reumatoid artrit, inflammatorisk tarmsjukdom och lymfom. Whipples sjukdom är en progredierande infektionssjukdom med letal utgång om den inte upptäcks och behandlas i tid. Därför är det viktigt att ha den i åtanke som en viktig differentialdiagnos vid långvariga ospecifika symtom, särskilt i kombination med feber.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Symtom och kliniska fynd vid Whipples sjukdom [17]
Vanliga symtom och kliniska fynd
- Migrerande artralgi/artrit (70–90 procent) med eller utan feber (40–60 procent)
- Buksmärtor (50–90 procent) och diarréer (70–85 procent) som kan bli blodiga under sjukdomsförloppet
- Viktnedgång (80–90 procent)
- Lymfadenopati (40–60 procent)
- Hypoalbuminemi (90 procent)
- Anemi (75–90 procent)
- SR-stegring (70 procent)
- Kardiell påverkan (35–65 procent)
- Pulmonell påverkan (35–60 procent)
Mindre vanliga symtom och kliniska fynd
- Hypotoni (35 procent)
- Perifera ödem (30 procent)
- CNS-påverkan (20–30 procent)
- Okulär påverkan (5–15 procent)