Patienter med akut och kronisk leversjukdom har en ändrad balans i hemostasen vilket innebär en ökad benägenhet för både blödning och trombos.
Blödningar är primärt relaterade till portal hypertension snarare än till defekt hemostas.
Det finns väletablerade kliniska riklinjer för handläggning av patienter med levercirros och esofagusvaricer.
Epidemiologiska studier har påvisat en överrisk för venös tromboembolism vid levercirros.
Behandling av patienter med levercirros och venös trombos är inte väl dokumenterad. Vid symtomatisk och utbredd trombotisering i portasystemet och hos patienter som är aktuella för levertransplantation bör behandling med antikoagulantia dock övervägas.
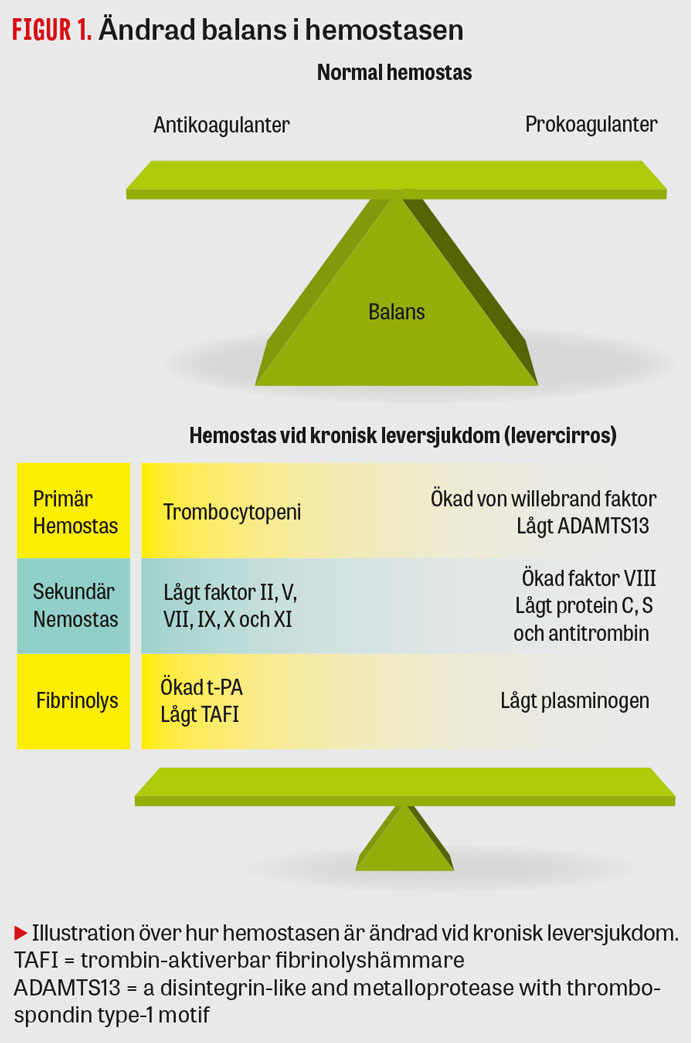
Under det senaste årtiondet har förståelsen av koagulationsrubbningar vid levercirros och portal hypertension inneburit ett paradigmskifte. Tidigare antogs att patienter med leversjukdom och påverkade koagulationsprov inklusive trombocytopeni hade en naturlig blödningsbenägenhet och därmed minskad trombosrisk. Detta har visat sig vara fel. Utöver en ökad blödningsrisk har dessa patienter även en paradoxal benägenhet till venösa tromboser.
De allra flesta patienter med levercirros har en svagt balanserad hemostas [1]. Den ändrade balansen sker genom kompensatoriska mekanismer i både primär och sekundär hemostas samt i det fibrinolytiska systemet. Till exempel kompenseras trombocytopenin (relaterad till portal hypertension och en minskad syntes av trombopoetin i levern) av en ökad produktion av von Willebrandfaktor [1]. Minskad syntes av prokoagulanter såsom fibrinogen och flera koagulationsfaktorer (II, V, VII, IX, X, XII) kompenseras av ökning av koagulationsfaktor VIII från kärlendotel samt en minskad syntes av antikoagulerande faktorer som protein C, protein S och antitrombin i levern (Figur 1) [1].
Den ändrade balansen i hemostasen kan lätt tippa över till antingen blödning eller trombos på grund av till exempel infektion, njursvikt och endotelskada.
Att predicera eventuell blödning eller venös trombos hos en enskild patient med levercirros är en utmaning. De laboratorieanalyser som vanligtvis används för att förutsäga blödningsrisk, det vill säga protrombinkomplex (P-PK, INR), aktiverad partiell tromboplastintid (P-APTT), och trombocytpartikelkoncentration (B-TPK), kan inte på ett tillförlitligt vis påvisa blödningsrisken hos dessa patienter [1]. Andra mer globala koagulationsanalyser (t ex tromboelastografi och trombingenereringsanalyser) är för närvarande endast tillgängliga på ett fåtal centra. Det finns i dag inget enskilt test som exakt kan förutsäga blödnings- eller trombosrisk hos patienter med levercirros.
Det kan således vara förbryllande att ena dagen ta hand om en patient som ymnigt blöder från esofagusvaricer, bara för att upptäcka en akut portavenstrombos några dagar senare. I den här artikeln går vi igenom den initiala handläggningen av dessa tillstånd.
Varixblödning
Över hälften av patienterna med levercirros har esofagusvaricer. Förekomsten korrelerar till leversjukdomens svårighetsgrad (förekommer hos 40 procent av patienter med Child–Pugh A-cirros och 85 procent hos dem med Child–Pugh C-cirros) och portatrycket. Blödning sker årligen hos 5–15 procent av de patienter med esofagusvaricer. Riskfaktorer för blödning är varixstorlek, levercirrosens svårighetsgrad (främst Child–Pugh B/C; i Child–Pugh-skalan A–C ingår serumbilirubin och albumin, PK-värde samt förekomst av ascites och leverencefalopati) eller förekomst av punktformiga rodnader eller röda stråk [2, 3].
Behandling av varixblödning
Övre gastrointestinal blödning hos patienter med levercirros uppstår mestadels på grund av portal hypertension där esofagusvaricer utgör cirka 70 procent, gastriska varicer 10 procent och portal hypertensiv gastropati 10 procent. Andra lesioner (peptiskt sår,
erosiv gastrit, refluxesofagit, Mallory–Weiss syndrom, tumörer) är ovanliga blödningskällor [4].
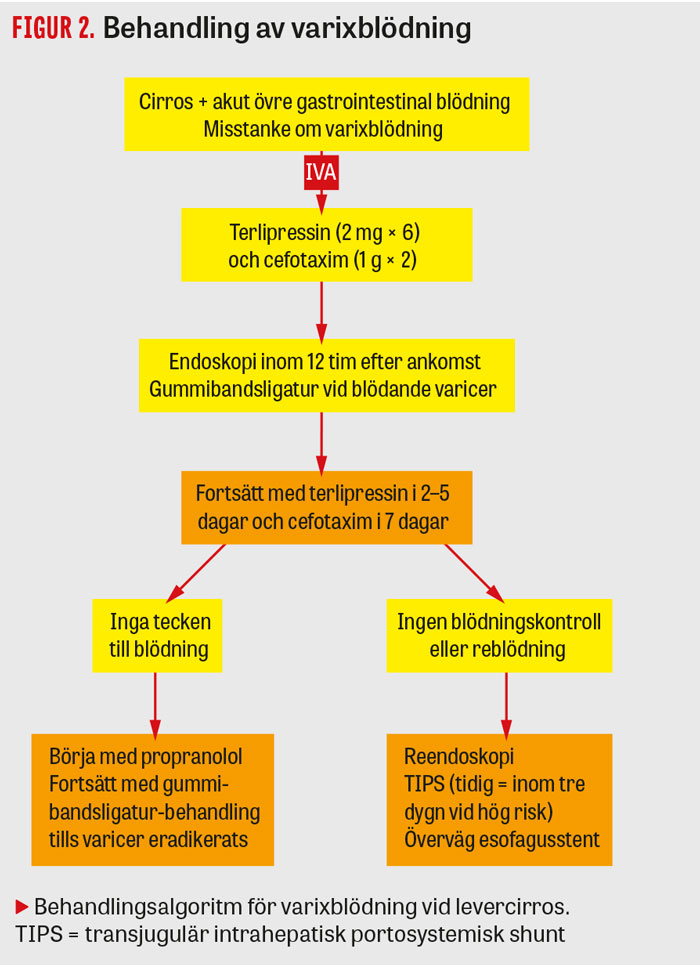
Vid akut övre gastrointestinal blödning hos patienter med känd eller misstänkt levercirros påbörjas omedelbart vasoaktiv behandling med terlipressin och antibiotika intravenöst (cefotaxim eller ciprofloxacin), se Figur 2. Båda dessa medicinska behandlingar förbättrar överlevnaden signifikant [2, 3]. Ventrikelsond sätts in och patienten vårdas på IVA. Snar/tidig endoskopisk behandling med i första hand ligaturer och i andra hand skleroterapi av van skopist eftersträvas vid fynd av blödande esofagusvaricer. Blödande gastriska varicer behandlas med vävnadslim. Blodtransfusion ges för att eftersträva ett B-Hb på 80 g/l. Övertransfusion till högre B-Hb-värden ska undvikas på grund av ökad reblödningsrisk [2, 3]. Vid reblödning görs ny gastroskopi med ligaturbehandling eller skleroterapi. Esofagusstent kan temporärt användas vid okontrollerbar blödning medan Sengstakensond endast används i undantagsfall. Misslyckas två endoskopiska terapiförsök övervägs transjugulär intrahepatisk portosystemisk shunt (TIPS) [2]. Hos patienter med förhöjd risk för blödningsrelaterad mortalitet (avancerad levercirros Child–Pugh C <13 poäng eller Child–Pugh B med pågående blödning under första endoskopin) verkar en tidig TIPS (täckt TIPS inom 3 dygn) förbättra överlevnaden [5].
Efter varixblödning ges sekundärprofylax med propranolol och endoskopisk ligaturbehandling [2, 3]. Ligaturbehandlingen upprepas var 3–5:e vecka tills eradikaton av varicerna uppnås. Efter obliteration görs gastroskopikontroll efter 3, 6, 12 månader och därefter årligen [2].
Portavenstrombos
Prevalensen av portavenstrombos varierar mellan <1 procent (kompenserad cirros) och 26 procent (dekompenserad cirros) men kan uppgå till 44 procent vid samtidig hepatocellulär cancer [6]. Trombofili, särskilt mutation i protrombingenen (G20210A), kan spela roll även om tillgängliga data är motstridiga [7]. Lokala inflammatoriska tillstånd (t ex kronisk pankreatit), infektioner och kirurgi kan också öka risken [6, 7].
Portavenstrombos upptäcks oftast vid de ultraljudsövervakningar som i dag regelbundet utförs på patienter med levercirros i syfte att tidigt upptäcka små behandlingsbara hepatocellulära tumörer. Patienten är oftast asymtomatisk, och trombosen ockluderar portavenen endast partiellt. När trombotiseringen är komplett eller har en extensiv utbredning genom att till exempel engagera mesenterialvener har patienten oftast symtom. Man ska därför ha diagnosen i åtanke när en patient med levercirros söker för buksmärta, ökad ascites eller blödande varicer.
Behandling av portavenstrombos
I en randomiserad öppen studie rapporterades nyligen att portavenstrombos framgångsrikt kunde förebyggas hos patienter med avancerad levercirros genom behandling med ett lågmolekylärt heparin i profylaktiska doser under 48 veckor [8]. Dessutom var risken för dekompensation betydligt lägre och överlevnaden bättre i behandlingsgruppen. En större bekräftande studie behövs dock innan primärprofylaktisk behandling kan rekommenderas.
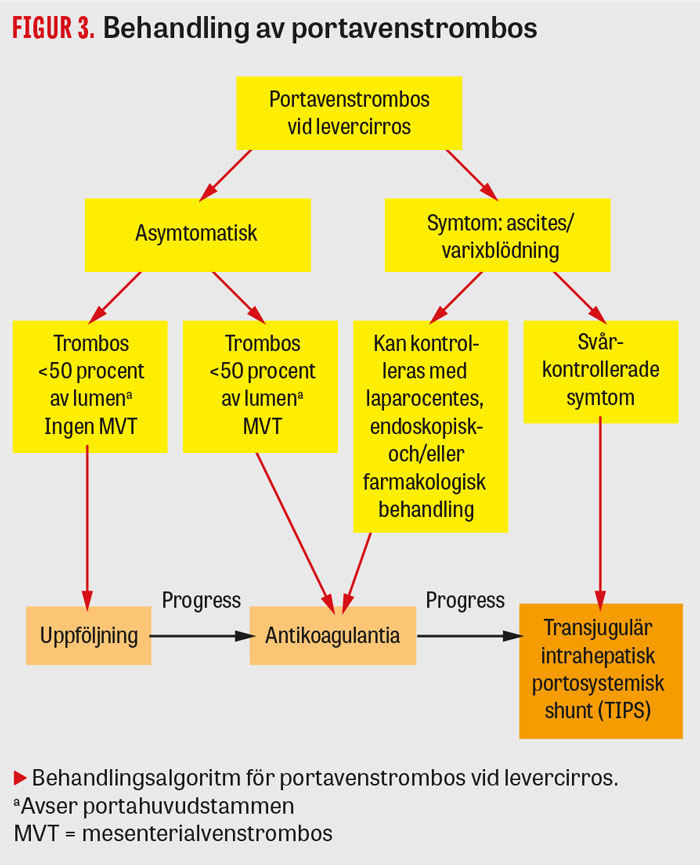
Prospektiva randomiserade behandlingsstudier vid portavenstrombos saknas. Aktuella rekommendationer baseras på retrospektiva studier, extrapolering av data från andra patientpopulationer och expertråd (Figur 3). Vid symtomgivande tromboser, framför allt om mesenterialvenerna är engagerade, liksom hos patienter med påvisade trombogena riskfaktorer, är det oftast försvarligt att behandla med antikoagulantia [7, 9]. Portavenstrombos kan utgöra en betydande teknisk svårighet vid levertransplantation och försämra överlevnaden efter ingreppet, varför man hos patienter som är aktuella för transplantation alltid bör överväga behandling [9].
Samtliga patienter ska genomgå gastroskopi för att värdera om varicer föreligger. Vid förekomst av små varicer utan blödningstecken är behandling med antikoagulantia inte kontraindicerad. Större varicer behandlas dock enligt gällande riktlinjer innan behandling med antikoagulantia inleds.
Warfarin och preparat med lågmolekylärt heparin är mest studerade och sannolikt effektmässigt likvärdiga [7, 9]. I klinisk praxis ges huvudsakligen lågmolekylärt heparin fram till levertransplantation, eller tills vidare om det föreligger en bestående trombofilifaktor. Rekanalisering av trombosen sker hos upp till 50 procent av patienterna. Risken för retrombos efter levertransplantation är cirka 5 procent om man inte ger antikoagulantia [6]. Det är ännu oklart om portavenstrombos påverkar mortaliteten vid levercirros [10].
Vid svårbemästrade varixblödningar, behandlingsrefraktär ascites eller progredierande trombos trots antikoagulantia kan TIPS övervägas [7, 9].
Djup ventrombos och lungemboli
Prevalensen av djup ventrombos i nedre extremiteter och/eller lungemboli hos sjukhusvårdade patienter med levercirros varierar mellan 0,5 och 6,3 procent. Förekomsten ökar med graden av leversvikt [11]. Den relativa risken för venös tromboembolism vid levercirros har i Danmark nyligen beräknats vara fördubblad jämfört med populationsbaserade kontroller [12]. D-dimer (P-D-dimer) är oftast förhöjd vid levercirros, och värdet korrelerar med graden av leversvikt [13]. Provet är därför ospecifikt som markör för venös tromboembolism vid levercirros. Hos sjukhusvårdade patienter med kända riskfaktorer för venös tromboembolism men med samtidig förekomst av levercirros används trombosprofylax i cirka 25 procent av fallen, vilket är betydligt lägre än hos dem utan leversjukdom. Sannolikt beror detta på en falsk oro för blödning på grund av högt PK-INR [11].
Behandling av djup ventrombos och lungemboli
Randomiserade kontrollerade studier av prevention och behandling vid levercirros och djup ventrombos/lungemboli saknas. De data som föreligger ger dock stöd för behandling med antikoagulantia hos selekterade patienter med levercirros. Säkerheten tycks vara jämförbar med behandling av andra internmedicinska patientkategorier [14]. I klinisk praxis ges därför antikoagulantia (huvudsakligen i form av lågmolekylärt heparin) till patienter med levercirros och samtidig djup ventrombos/lungemboli när inga uppenbara kontraindikationer såsom pågående blödning, uttalad trombocytopeni (<50 × 109/l), grav njursvikt eller stora esofagusvaricer föreligger.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.