Överlevnaden till 1 års ålder är hög hos extremt för tidigt födda barn (<28 graviditetsveckor) i Sverige, vilket är kopplat till en höggradigt genomförd centralisering av prenatal och neonatal vård.
Förekomsten av neonatal sjuklighet efter extremt förtidig födelse är i hög grad kopplad till framtida funktionsnedsättning hos det växande barnet och utgör en stor kvarstående utmaning.
Det finns ett tydligt behov av nya evidensbaserade preventiva interventioner liksom validering av existerande kliniska behandlingar.
Omhändertagandet av extremt för tidigt födda barn (födda före 28 graviditetsveckor) kännetecknas av medicinska, etiska och ekonomiska utmaningar. I Sverige är vården av denna grupp nyfödda och gravida kvinnor med hotande extrem förtidsbörd centraliserad till regionsjukhus, vilket har varit av stor betydelse för utveckling av medicinsk kompetens och etablering av nationella riktlinjer.
I Sverige föds årligen ca 350 barn extremt för tidigt. I en nationell kartläggning av levande födda barn förlösta mellan 22 + 0 och 26 + 6 graviditetsveckor under åren 2014–2016 var 1-årsöverlevnaden 77 procent att jämföra med 70 procent under åren 2004–2007 [1]. En dynamisk utveckling av intensivvård och ökad förståelse för interaktionen mellan omogna organsystem och postnatal miljö har bidragit till världsledande överlevnadssiffror.
Den svenska EXPRESS-studien (Extremely preterm infants in Sweden study) visade att hög obstetrisk och neonatal aktivitetsgrad vid mycket låg gestationsålder (22–24 graviditetsveckor) var associerad med lägre perinatal mortalitet [2]. Hög obstetrisk aktivitetsnivå inbegrep bl a förlossning på enhet med neonatal intensivvård, användning av prenatala steroider, förlossning med kejsarsnitt även vid låg gestationsålder och tokolytisk behandling. Hög neonatal aktivitetsnivå inkluderade bl a neonatolog närvarande vid födseln samt tidig surfaktanttillförsel. Några av dessa åtgärder kan diskuteras. Till exempel måste tokolytisk behandling och kejsarsnitt vid extremt tidig gestationsålder balanseras mot moderns hälsa och konsekvenser för framtida barnafödande.
En betydande andel av extremt för tidigt födda barn drabbas av svår neonatal sjuklighet med långtgående konsekvenser för framtida psykomotorisk utveckling och hälsa. Neonatalvården står därför inför stora utmaningar att bättre förstå påverkbara sjukdomsmekanismer och därmed kunna förebygga framtida funktionsnedsättning hos det växande barnet.
Nutrition och tillväxt
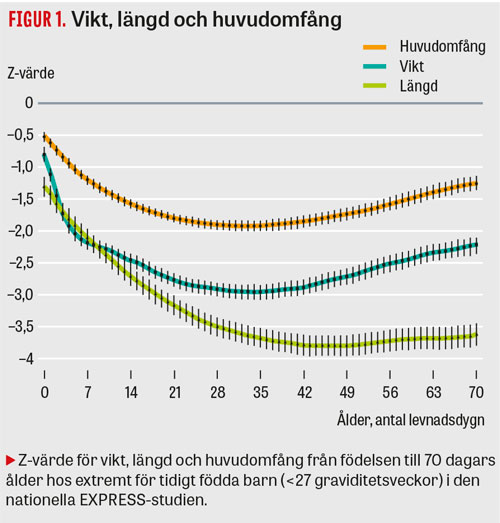
Extremt för tidigt födda barn har mycket hög risk att utveckla allvarlig malnutrition, trots att de vårdas på moderna neonatalavdelningar. Orsakerna till detta är bl a avsaknad av näringsreserver vid födelsen, höga näringsbehov för tillväxt och organutveckling samt praktiska svårigheter med både enteral och parenteral nutrition hos svårt sjuka barn. En majoritet av barnen i EXPRESS-studien fick under sina första 4 levnadsveckor betydligt lägre intag av energi och protein än rekommenderat och de uppvisade en kraftig postnatal tillväxthämning (Figur 1) [3]. Lågt energiintag under de första 4 levnadsveckorna var en oberoende riskfaktor för prematuritetsretinopati grad 3 eller högre [4].
Andra studier har bekräftat att ett optimerat näringsintag från enteral och parenteral nutrition är associerat med lägre risk för prematuritetsretinopati och bronkopulmonell dysplasi [5], bättre huvudomfångstillväxt (en markör för hjärnans tillväxt) och minskad risk för allvarliga elektrolytrubbningar, bl a hypernatremi och hypofosfatemi som båda är vanliga och potentiellt livshotande komplikationer hos extremt för tidigt födda barn.
Förbättrad näringstillförsel till extremt för tidigt födda barn har identifierats som ett av de viktigaste områdena för kvalitetsförbättring inom neonatalvården, och det har skett stora framsteg i Sverige under det senaste decenniet. Nya IT-system för beslutsstöd och monitorering av nutrition och tillväxt har visats förbättra både näringsintag och tillväxt. Mer näringstäta parenterala nutritionslösningar har visat sig förbättra näringsintag och tillväxt hos barn med mycket låg födelsevikt [6]; detta är viktigt då man ofta av kliniska skäl har ett önskemål att begränsa vätskeintaget hos dessa barn. Hypofosfatemi har visat sig vara vanligt förekommande och kan i vissa fall vara allvarlig och livshotande. Det är därför viktigt att ha en bra balans mellan kalcium, fosfor och aminosyror i parenterala nutritionslösningar och att analysera fosfat i plasma under de första levnadsdagarna hos dessa barn.
Det finns fortfarande ett flertal kunskapsluckor beträffande vilken nutrition som ger bästa hälsoutfall hos för tidigt födda barn, såväl vad gäller enteral som parenteral nutrition. En fråga där det finns stora regionala skillnader är hur man ska handlägga hyperglykemi. En aktuell svensk studie visar att hyperglykemi är mycket vanlig hos extremt för tidigt födda och associerad med ökad mortalitet och att insulinbehandling var associerad med lägre mortalitet hos barn med hyperglykemi [7]. Detta är exempel på ett område där fler studier behövs för att ge bättre underlag för riktlinjer för nutrition till för tidigt födda barn.
Bronkopulmonell dysplasi
Bronkopulmonell dysplasi är i dag ett av de vanligaste kroniska sjukdomstillstånden hos extremt för tidigt födda barn och drabbar över 40 procent av barnen. Trots förbättringar i omhändertagandet av för tidigt födda barn har incidensen snarast ökat, sannolikt på grund av högre överlevnad hos de mest omogna barnen. Sjukdomen är kopplad till svårigheter senare i livet, bl a till ökad dödlighet, hjärt–kärlproblem liksom motoriska och kognitiva funktionsnedsättningar.
Diagnosen bronkopulmonell dysplasi är unik såtillvida att den definieras av lungsjukdomens behandling med syrgas vid 36 veckors korrigerad graviditetsålder. När bronkopulmonell dysplasi beskrevs för 50 år sedan var det med utgångspunkt från lungpatologiska fynd, röntgenfynd och kliniskt förlopp.
Denna sjukdomspresentation har på senare tid kallats för »gammal« bronkopulmonell dysplasi till skillnad från den »nya« i dagens population. Man har kommit till insikten att dagens »nya« bronkopulmonella dysplasi beror på en kombination av pre- och postnatala faktorer som stör lungutvecklingen hos barn som föds extremt för tidigt. Barn som utvecklar »ny« bronkopulmonell dysplasi har avstannad lungutveckling, som leder till en förenklad lungstruktur som försvårar det normala gasutbytet, vilket i sin tur ökar sjukligheten [8].
Att födas mycket för tidigt har en effekt på lungfunktionen i sig. Svårighetsgraden av bronkopulmonell dysplasi kan förstås som ett kontinuum av avvikelse i lungfunktionen från lindrig till svår (Figur 2). Barn med bronkopulmonell dysplasi uppvisar generellt nedsatt lungfunktion under den tidiga barnaåldern och under tonåren [9].
En relevant fråga är om man ska koncentrera resurserna på att förhindra utveckling av bronkopulmonell dysplasi eller behandla uppkommen sjukdom. Att förhindra en förtidig förlossning vore förstås det optimala, men där är vi inte än. Behandling av etablerad bronkopulmonell dysplasi är för det mesta empirisk och saknar stark evidensbas.
Påbörjad mekanisk ventilation av ett extremt för tidigt fött barn utgör en av de mest signifikanta riskfaktorerna för utveckling av bronkopulomonell dysplasi. Detta faktum kvarstår trots den vidareutveckling som skett av olika ventilationsmetoder under de senaste decennierna. Det finns i dag god evidens för att användning av kontinuerligt positivt luftvägstryck (CPAP) som första val av andningsunderstöd minskar risken för bronkopulmonell dysplasi, även om behandlingseffekten är relativt liten.
Under 1990-talet började evidens komma för att inflammation är central i patofysiologin vid utveckling av bronkopulmonell dysplasi. I ett försök att bromsa sjukdomsutveckling behandlades barnen med höga intravenösa doser av dexametason. Denna behandling visade sig kunna minska antalet vårddygn med mekanisk ventilation och minska utveckling av bronkopulmonell dysplasi. Nackdelen visade sig vara att förekomsten av cerebral pares ökade oacceptabelt mycket och att systembiverkningar var vanliga. Att använda intravenöst hydrokortison i fysiologiska doser eller inhalationssteroider för att uppnå en lokal effekt i lungan har utretts som alternativ.
Sammantaget verkar det inte som om profylaktisk behandling med steroider är befogad för att minska incidensen av bronkopulmonell dysplasi. I den kliniska vardagen blir det därför ett avvägt beslut huruvida behandling med steroider senare i förloppet är till fördel för den enskilda patienten [10].
Intraventrikulär hjärnblödning
Intraventrikulär hjärnblödning är en komplikation till förtidig födelse med svåra konsekvenser för barnets framtida psykomotoriska utveckling. Hos barn födda extremt för tidigt i Sverige under åren 2014–2016 var förekomsten av svår intraventrikulär hjärnblödning 10 procent hos dem som överlevde till 1 års ålder [1]. Orsaken till förtidig födelse har visats modifiera risken för att utveckla intraventrikulär hjärnblödning: inflammatoriska tillstånd såsom korioamnit ökar risken, medan havandeskapsförgiftning innebär betydligt lägre risk.
Blödningen vid intraventrikulär hjärnblödning inträffar nästan alltid under de 3 första levnadsdygnen och upptäcks med ultraljud, en screeningundersökning som utförs bedside av neonatologer. Blödningen utgår oftast från kärl belägna i germinalmatrix, ett område beläget vid nucleus caudatus strax under sidoventriklarna. Germinalmatrix består av endotel och tidiga stadier av gliaceller och neuron i en hög celldelningsaktivitet. Blodkärlen i germinalmatrix har ett lägre innehåll av strukturella komponenter, vilket väl kan förklara skörhet och benägenhet till bristning [11]. Kliniska händelser som ger upphov till snabba förändringar i hjärnans blodflöde såsom blodtrycksvariation, hyperkapni och hyperosmolaritet är välkända riskfaktorer för intraventrikulär hjärnblödning.
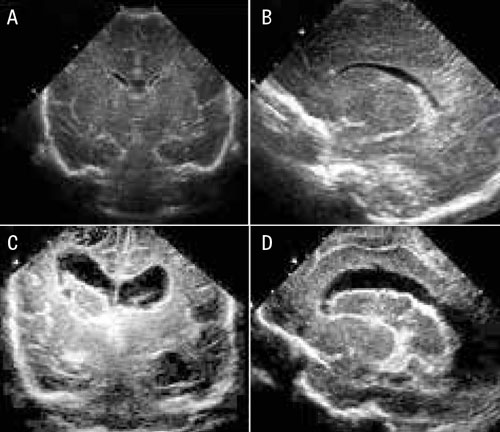
Utbredningen av blödningen ligger till grund för en stadieindelning, som har prognostisk betydelse. Grad I-blödningar är begränsade till germinalmatrix, medan blödningen vid grad II bryter igenom ependymet och blod kan visualiseras i sidoventrikeln. Vid grad III täcker den intraventrikulära blödningen >50 procent av den vid ultraljud visualiserade ventrikelytan (Figur 3). Grad IV definieras bättre som en periventrikulär hemorragisk infarkt och utgörs av blödning lokaliserad i ischemisk periventrikulär hjärnvävnad. I kliniska studier kategoriseras grad III och periventrikulär hemorragisk infarkt som svår intraventrikulär hjärnblödning och har dyster prognos; 40–80 procent av överlevande barn utvecklar posthemorragisk ventrikeldilatation/kognitiv funktionsnedsättning och/eller cerebral pares.
Posthemorragisk ventrikeldilatation är en svår komplikation, där mängden blod deponerad i det intraventrikulära rummet utgör en riskfaktor för patologisk vidgning av ventrikelsystemet. Neurokraniet med sina suturer kännetecknas av uttalad eftergivlighet, varför ackumulation av cerebrospinalvätska i ventrikelsystemet efter intraventrikulär blödning tidigt leder till ökade ventrikelmått. I tidigare studier behövde >50 procent av barn med svår intraventrikulär blödning inläggning av en livslång ventrikulo-peritoneal shunt. Tidig inläggning av en temporär ventrikelreservoar för tappning av cerebrospinalvätska redan vid låggradig ventrikeldilatation verkar kunna reducera behovet av permanent ventrikuloperitoneal shunt [12].
I dag saknas preventiva och terapeutiska kliniska behandlingsstrategier för intraventrikulär blödning. Tidig tillförsel av insulinlik tillväxtfaktor 1 (IGF-1) studeras med syfte att uppreglera strukturella kärlkomponenter och därmed förebygga utveckling av intraventrikulär blödning [13]. Prenatal behandling med magnesiumsulfat verkar kunna ha förebyggande effekt på intraventrikulär blödning, men dosering och verkningsmekanism är ännu inte väl definierade. Prekliniska studier har visat att intraventrikulärt belägna blodkomponenter har en kapacitet att migrera ut i hjärnvävnad, med skadliga oxidativa och proinflammatoriska effekter. Tidig elimination av blodprodukter alternativt blockering av kritiska metabola steg utgör möjliga, men tyvärr ännu ej kliniskt användbara, strategier.
Prematuritetsretinopati
Prematuritetsretinopati är en neurovaskulär sjukdom som drabbar drygt 70 procent av alla barn i Sverige som fötts före 27 veckors gestationsålder; ca 20 procent behöver behandlas för att inte bli blinda [1, 14].
Hur prematuritetsretinopati uppstår är fortfarande oklart. Allvarlig prematuritetsretinopati har en initial fas, där de retinala blodkärlen drabbas av hämmad tillväxt och/eller tillbakabildas. Den avaskulära näthinnan blir i en senare fas hypoxisk. Detta leder (mycket förenklat) till uppreglering av vaskulär endotelial tillväxtfaktor (VEGF), som stimulerar en okontrollerad angiogenes, vilken kan medföra traktion och näthinneavlossning.
De viktigaste riskfaktorerna för prematuritetsretinopati är låg gestationsålder, syrgasbehandling och dålig tillväxt, både före och efter födelsen. Man har antagit att näthinnan är hyperoxisk i den första fasen av prematuritetsretinopati. Högre målsaturation ger mer prematuritetsretinopati än lägre, men det är ofta svårt att uppnå eftersträvad syremättnad. På senare tid har man funnit att barn med måttlig till svår prematuritetsretinopati hade mer fluktuerande syremättnad än barn med ingen eller lindrig sjukdom. Anemi (Figur 4) [15] och lågt antal trombocyter är andra riskfaktorer.
I Sverige genomgår alla barn som fötts med gestationsålder <31 veckor upprepade ögonundersökningar av erfarna ögonläkare. De allra flesta behöver aldrig behandlas för prematuritetsretinopati. Därför har man utvecklat metoder att bedöma ett barns personliga risk för behandlingskrävande retinopati för att kunna anpassa undersökningsintervallen efter risken. De flesta av dessa metoder är baserade på barnets viktutveckling [16].
Tidigare användes kryoterapi, men nu är laserbehandling, som destruerar större delen av den avaskulära näthinnan, den mest använda evidensbaserade behandlingsmetoden vid svår prematuritetsretinopati. Intraokulära injektioner med anti-VEGF-antikroppar används allt mer utanför godkänd indikation (off label), även om den optimala dosen är okänd och VEGF i blodet reduceras i många veckor med okänd effekt på det omogna barnets utveckling.
Det skulle vara mycket bättre om man kunde förebygga allvarlig prematuritetsretinopati. Åtgärder för prevention har bestått av åtgärder för bättre syrgaskontroll och försök att förbättra tillväxten genom att ge mer näring, omega-6 och omega-3 långa fettsyror (Clinicaltrials.gov NCT03201588) och tillväxtfaktorn IGF-1 (Clinicaltrials.gov NCT01096784).
Betablockeraren propranolol har kunnat förhindra patologisk angiogenes i retina men med en del allvarliga biverkningar.
Den kanske mest lovande och biverkningsfria förebyggande behandlingen kan vara att ge så mycket som möjligt av mammans bröstmjölk de första veckorna efter födelsen i stället för alternativet, som i Sverige är pastöriserad donerad bröstmjölk. Pastöriseringen förstör många bioaktiva faktorer i mjölken, och den egna mammans mjölk har visat sig ge bättre tillväxt, mindre prematuritetsretinopati och bättre psykomotorisk utveckling än den pastöriserade mjölken [17].
Nekrotiserande enterokolit
En av de mest fruktade komplikationerna inom neonatalvården är nekrotiserande enterokolit. Tillståndet orsakas av en kraftig inflammation i tarmslemhinnan och debuterar med matintolerans på grund av paralytisk ileus, blodiga avföringar och kraftigt uppspänd buk. Tillståndet progredierar ofta snabbt till cirkulationschock och multiorgansvikt. En vanlig komplikation är tarmperforation, och hos upp mot 50 procent av drabbade barn krävs kirurgi. Mortaliteten är så hög som 15–30 procent [18].
Barn som haft nekrotiserande enterokolit löper senare ökad risk för neurologisk funktionsnedsättning. En annan vanlig komplikation är korta tarmens syndrom med långvarigt behov av parenteral nutrition även efter det att barnet lämnat neonatalperioden. Kostnaden för nekrotiserande enterokolit är hög och har i USA beräknats till 500 000 dollar per barn.
Trots att neonatalvården utvecklats dramatiskt under de senaste decennierna med kraftigt ökad överlevnad för barn som föds extremt för tidigt, har incidensen av nekrotiserande enterokolit inte minskat; i Sverige ser den snarare ut att ha ökat. I EXPRESS-studien från åren 2004–2007 var incidensen hos extremt för tidigt födda barn 6 procent, medan den i de senast validerade siffrorna från Svenskt neonatalt kvalitetsregister (snq.se) har stigit till 10 procent. Orsaken till detta är oklar men en del av förklaringen kan vara den ökade överlevnaden av barn födda i graviditetsvecka 22–25. Incidensen av nektrotiserande enterokolit är särskilt hög i denna grupp.
De bakomliggande mekanismerna är inte helt klarlagda. Mer än 90 procent av de spädbarn som utvecklar sjukdomen är födda för tidigt. Hos fullgångna barn orsakas nekrotiserande enterokolit av perinatal asfyxi, sepsis eller medfödd hjärtsjukdom och är associerad med svåra cirkulationsstörningar som påverkar cirkulationen i tarmen. Hos extremt för tidigt födda barn brukar den höga risken hänföras till deras omogna immunsystem, bristande barriärfunktion, nedsatta tarmmotilitet och bristfälliga reglering av tarmens mikrocirkulation.
Den senaste tiden har även forskning fokuserad på det prematura barnets tarmmikrobiota visat en lägre diversitet än hos nyfödda fullgångna barn. Det har funnits stora förhoppningar om kosttillskott med probiotiska bakterier som effektiv prevention, och metaanalyser utförda på mer än 20 prövningar har bekräftat att probiotika har preventiv effekt [19]. Vid närmare granskning visar det sig dock att probiotika inte har effekt på de extremt för tidigt födda barnen. Troligen är andra faktorer än tarmens mikrobiota viktigare för utvecklingen av nekrotiserande enterokolit i denna patientgrupp.
Den preventionsåtgärd som visat sig ha störst effekt är exklusiv tillmatning med bröstmjölk i stället för komjölksbaserad bröstmjölksersättning. Det får i dag alla extremt för tidigt födda barn i Sverige tack vare 100-procentig täckning med bröstmjölksbanker. Frågan kvarstår dock varför så många extremt för tidigt födda barn får nekrotiserande enterokolit i Sverige trots detta. Nyligen visade en svensk forskargrupp att sammansättningen av s k oligosackarider var annorlunda i bröstmjölk från mammor till extremt för tidigt födda barn som utvecklat nekrotiserande enterokolit [20]. Extra tillskott av specifikt utvalda humana oligosackarider kan därför vara en lovande framtida prevention.
Avslutning
Den starkaste enskilda riskfaktorn för samtliga beskrivna former av svår sjuklighet under nyföddhetsperioden är grad av omognad vid födelsen. I den tidigare refererade nationella sammanställningen av barn födda före 27 graviditetsveckor under 2014–2016 utvecklade 62 procent av barnen ett eller flera av tillstånden bronkopulmonell dysplasi, svår intraventrikulär hjärnblödning, nekrotiserande enterokolit eller behandlingskrävande prematuritetsretinopati [1].
Förekomst av svår neonatal sjuklighet var därmed lägre än den som beskrevs i den tidigare nationella kohorten (68 procent) från 2004–2007. Detta är glädjande, eftersom antalet barn födda i de lägsta graviditetsveckorna (graviditetsvecka 22 och 23) var betydligt större i den senare kohorten.
I en internationell jämförelse är överlevnaden i Sverige hög, speciellt uttalat i de lägsta graviditetsveckorna, vilket inte verkar ske till priset av högre förekomst av svår sjuklighet under nyföddhetsperioden.
Det finns i dag ett starkt behov av utveckling av evidensbaserade interventioner med preventiv effekt. Prenatal steroidbehandling, först beskriven redan under 1970-talet, är fortfarande unik i sin egenskap av intervention med preventiv effekt på svår sjuklighet hos extremt för tidigt födda barn. Behovet av såväl translationell forskning som validering av existerande kliniska behandlingar och omvårdnadsstrategier är stort för att i högre grad kunna förebygga svår sjuklighet hos extremt för tidigt födda barn.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.